EMA:s misslyckande med att återkalla COVID 19-sprutor trots att risk-nytta-balansen var obefintlig
EU:s säkerhetsrapport om mRNA-vaccin från Pfizer-BioNTech avslöjar förödande uppgifter
Det är hög tid att ställa EMA och EU-kommissionen och deras medskyldiga partner – med början hos WHO och FDA, CDC – till svars för deras pliktförsummelse att inte skydda folkhälsan genom att ignorera de uppenbara säkerhetssignalerna och stå fast vid det uppenbart felaktiga uttalandet att Pfizer-BioNTech COVID-19-vaccinets ”nytta-risk-profil är fortsatt gynnsam.” Denna säkerhetsrapport, som finns sedan länge och som offentlig-gjordes i augusti 2021, är ett solitt bevis på att de parter som var inblandade i utvärder-ingen och beslutet att tillåta COVID-19-vaccinationer att släppas ut på marknaden, var medvetna om de förödande konsekvenser de medförde. De misslyckades inte bara med sin skyldighet att korrekt utvärdera mRNA-vaccinationer innan de används på människor, utan fortsätter också att ignorera de säkerhetsindikatorer som finns och som orsakar omätbar skada och förstörelse.
Deras upprepade vägran att respektera sina lagliga mandat kräver en utredning av eventuella civilrättsliga och straffrättsliga överträdelser och en process för att hålla alla inblandade ansvariga.
Orsolya Gyorffy, CHD Europa
Ursprungligen publicerad av CHD Europe den 19 februari 2023
Tryckfel och graviditetsresultat ändrades den 22 februari 2023

EU:s säkerhetsrapport om mRNA-vaccinet från Pfizer-BioNTech avslöjar förödande data
EU:s första periodiska säkerhetsrapport (PSUR #1) på 286 sidor, som omfattar sexmånadersperioden från den 19 december 2020 till den 18 juni 2021, avslöjar förödande säkerhetssignaler för Pfizer-BioNTech Covid-19-vaccinet (COMIRNATY). Den offentlig-gjordes via en FOIA-förfrågan från en anonym läsare och lämnades till den österrikiska vetenskapliga och politiska bloggen TKP.
Enligt Europeiska läkemedelsmyndighetens definition: ” PSURs är säkerhetsövervakning av läkemedelsdokument som är avsedda att ge en utvärdering av förhållandet mellan risk och nytta för ett läkemedel vid bestämda tidpunkter efter godkännandet. Syftet med PSUR är att presentera en heltäckande och kritisk analys av produktens risk-nytta-balans, med beaktande av ny eller uppkommande säkerhetsinformation i samband med den kumulativa informationen om risker och nytta.
Det är MAH (innehavaren av godkännandet för försäljning), i detta fall BioNTech SE, som enligt lag är skyldig att lämna in PSUR:er till EMA tillsammans med en ansökningsavgift. EMA bedömer sedan den information som finns i rapporten för att avgöra om några nya risker har identifierats eller om balansen mellan risk och nytta har ändrats.
Jag har i stor utsträckning gått igenom omfattande Pfizer-BioNTech-vaccinrelaterade dokument, och den här rapporten var en av de mest uppseendeväckande, inte bara i förhållande till de fällande uppgifterna utan även till dess slutsats att ”nyttoriskprofilen för BNT162b2 fortfarande är gynnsam.”
De förödande uppgifterna
Nedan följer en översikt över det totala antalet ärenden (data efter marknadsföringen och data från kliniska prövningar) under den sex månader långa rapporteringsperioden:

- 327,827 fallbeskrivningar (personliga) som innehåller 1,172,882 händelser (allvarliga)
- Tre gånger så många rapporterade fall för kvinnor än män
- Störst antal rapporterade fall i åldersgruppen 31-50
- En tredjedel av fallen var bedömda som allvarliga
- 44% av fallen hade okända eller olösta resultat
- 84% av fallen hade ingen historisk komorbiditet
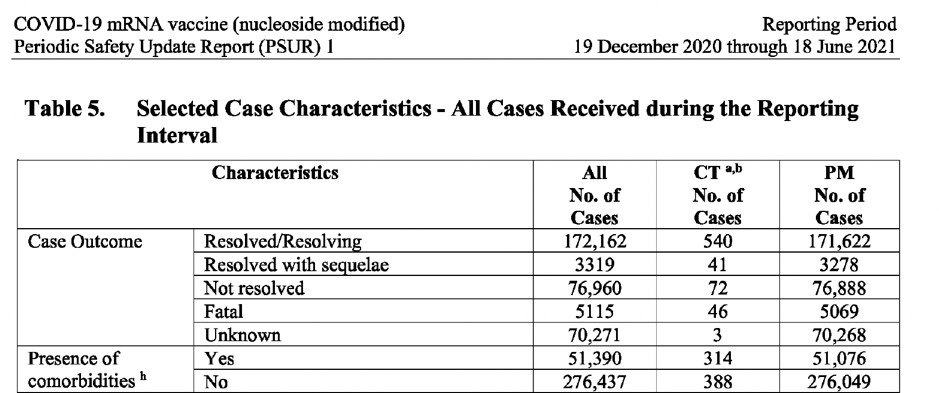
- 5115 dödsfall efter vaccinering
- 46% av dödsfallen inträffade hos dem utan komorbiditet
Tabellen nedan (hämtad från dokumentet) visar antalet fall uppdelat på: kön, ålder, land, fallets allvarlighetsgrad, resultat och förekomst av komorbiditeter.
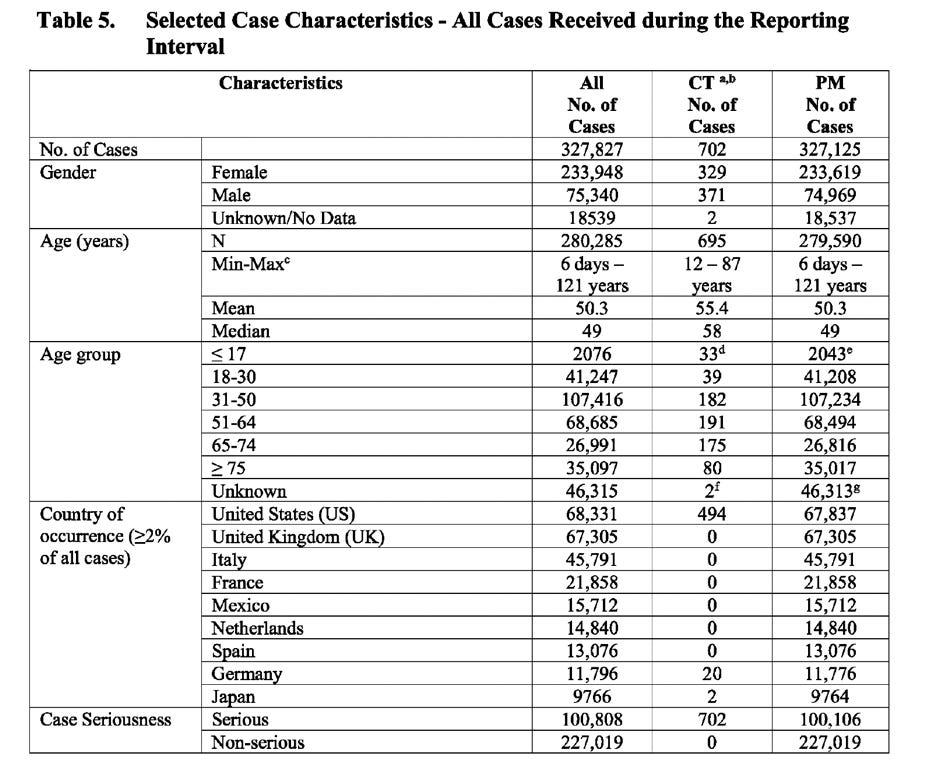
CT: Data från kliniska prövningar PM: Uppgifter efter marknadsintroduktion
Det som är anmärkningsvärt är att liknande resultat som angår: könsspecifika vaccin-säkerhetsrisker för kvinnor, individer (fall) som i genomsnitt drabbas av 3-4 biverkningar, ett stort antal rapporter med antingen okända och/eller olösta resultat, ett stort antal fall med okänt kön och en ovanlig gruppering av avgjorda/lösta fall hittades när jag analyserade det dokument som Pfizer utarbetat för FDA med titeln ”Cumulative Analysis of Post-Authorization Adverse Event Reports of PF-07302048 (BNT162B2) received through 28 February 2021”.
En slående skillnad mellan de två rapporterna är dock explosionen i antalet fall och hän-delser som registrerats i EU:s PSUR, som är sju gånger högre än Pfizers framläggande till FDA, som omfattade halva perioden.
I dokumentet anges att under rapporteringsintervallet uppskattades 635 763 682 doser ha administrerats över hela världen och tillägger: ”Det är inte möjligt att med säkerhet fastställa antalet individer som fått BNT162b2 under perioden för denna granskning.” Därför är det inte möjligt att extrapolera exakta incidenssiffror.
En viktig punkt att ta hänsyn till vid bedömningen av uppgifterna är dock omfattningen av underrapportering av fall. I en Harvard-studie drogs slutsatsen att endast 1-13 % av allvarliga biverkningar rapporteras. Vidare gav en systematisk genomgång av Hazell et al. bevis för att det finns en betydande och utbredd underrapportering av biverkningar till system för spontanrapportering, inklusive allvarliga biverkningar. Därför är det oro-väckande att även om antalet fall och händelser i rapporteringsintervallet verkar vara högt, kan de faktiska siffrorna ha varit mycket högre.
De drabbade yngre åldersgrupperna utan komorbiditet
Det är ett känt faktum att majoriteten av människor tillfrisknar helt efter att ha smittats av Covid-19, särskilt de som inte har några komorbiditeter (inga underliggande hälsoproblem) och som inte är äldre. PSUR-rapporten avslöjar dock en alarmerande annorlunda beskriv-ning när det gäller mottagarna av vaccinet från Pfizer-BioNTech: Hela 23 % av fallen av dem som drabbades av biverkningar efter att ha fått vaccinet återhämtade sig inte (de lämnades olösta) och för 21 % av fallen var resultatet helt okänt. Dessutom var det högsta antalet rapporterade fall i åldersgruppen 31-50 år, inte i den äldre befolkningen. När man analyserar uppgifterna efter godkännandet för dödsfall, uppdelade efter förekomst/ frånvaro av komorbiditet, i alla åldersgrupper upp till 64 år, inträffade fler dödsfall hos personer utan komorbiditet. Bland personer i åldern 17 år och yngre dog 22 personer som inte hade någon komorbiditet, jämfört med 1 person som hade det. Det är endast i åldersgruppen 65 år och äldre som antalet dödsfall med komorbiditet överstiger antalet dödsfall utan komorbiditet. (Se skärmdump nedan).
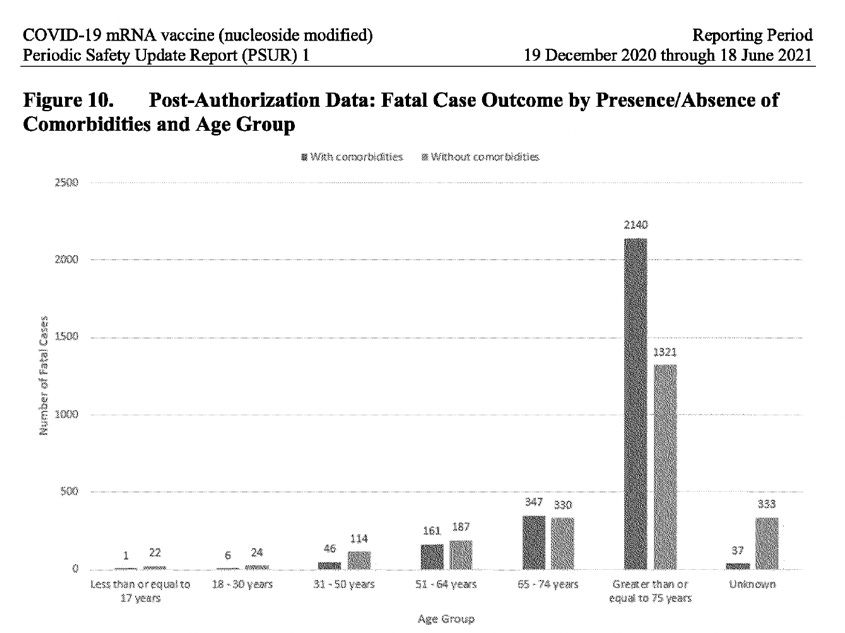
Det är mycket ovanligt att PSUR inte tog upp denna uppenbara säkerhetssignal som påverkar yngre åldersgrupper, utan i stället förteg den genom att säga att ”totalt sett är andelen fall med dödlig utgång något högre när komorbiditeter rapporteras.”
Fallet med Maddie de Garay
När man tittar på rapporteringen av data från kliniska prövningar för åldersgruppen 12-15 år i dokumentet har man gjort ett uppenbart utelämnande som kan beskrivas som en mörkläggning av Maddie de Garays fall.
I början av 2022 intervjuade jag Maddie de Garays mamma Stephanie. Maddie, som då var 12 år gammal, deltog i Pfizer/BioNTechs kliniska prövning för 12-15-åringar. Kort efter att ha tagit den andra dosen fick Maddie skador som förändrade hennes liv och gjorde henne orörlig och beroende av en sond. Maddies mamma berättade för mig att Pfizers huvud-ansvarige för studien med tonåringar, dr Robert Frenck, registrerade dotterns förödande skador som ”buksmärta” trots att han och de andra läkarna på sjukhuset i Cincinnati kände till alla hennes symptom.
Lägg märke till att ”buksmärta” är en av PT:erna (föredragna termer) i relevanta fall, som det hänvisas till i skärmdumpen nedan, för data från kliniska prövningar för 12-15-åringar.

PSUR undertecknades av Barbara de Bernardi, EU:s kvalificerade person för säkerhets-övervakning av läkemedel på Pfizer, två månader efter rapporteringsgränsen den 18 juni 2021. Det ovanliga är hur EMA:s CHMP rekommenderade Pfizer-BioNTech-vaccinet för barn i åldern 12-15 år, en månad före slutförandet av EU:s allra första periodiska säker-hetsuppdateringsrapport den 28 maj, med EMA som godkände det för denna sub-population bara några dagar senare. Varför ville de inte vänta på att detta viktiga dokument om säkerhetsövervakning som ger en utvärdering av vaccinets risk-nytta-balans skulle komma ut först, innan de fattade sitt beslut?
De dåliga partierna
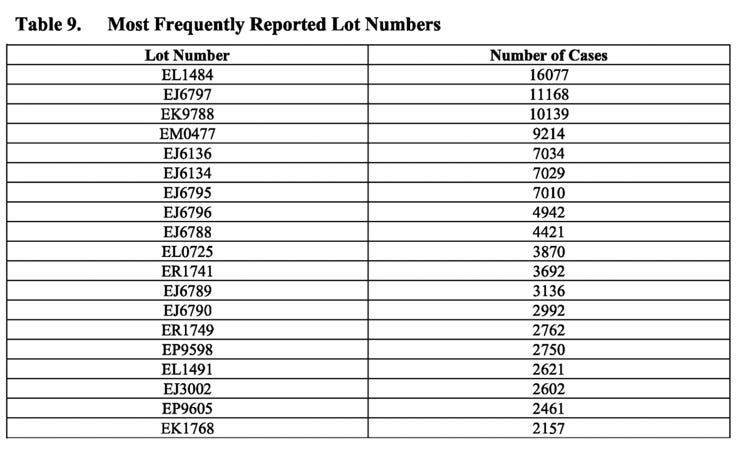
I tabellen ovan visas de vanligaste partinummer som rapporterats i fallrapporter. Lägg märke till frekvensen av fall som rapporterats för vissa partinummer, t.ex. partinummer EL1484, som rapporterades i 16 077 fall. PSUR fortsätter dock med att konstatera att ”generellt sett identifierades inga relaterade kvalitetsproblem i undersökningar av dessa partinummer … och alla potentiella signaler som indikerar ett potentiellt samband mellan ett säkerhetsproblem och ett visst parti, och som inte redan utvärderats som en del av andra signalaktiviteter, skulle utvärderas och eskaleras i enlighet med standard-förfarandena”
Detta uttalande är undvikande – till och med ordalaget ”generellt sett” antyder att det kan ha funnits kvalitetsrelaterade problem som identifierats i olika partier. I själva verket var det känt att de fanns. Jag har skrivit utförligt om de läckta e-postmeddelandena från EMA och andra Pfizer-BioNTech-relaterade dokument som avslöjade att tillsynsmyndigheterna var oroade över variationen mellan olika tillverkningssatser i vaccinets kvalitet ända fram till den tidpunkt då tillstånd för nödfall beviljades. Betydligt högre andelar av trunkerade mRNA-arter (inte intakta) identifierades i de kommersiella partierna av vaccinet jämfört med de partier som användes i de kliniska prövningarna. Dessa trunkerade arter klassificerades som ”produktrelaterade föroreningar.”
Vid sökning i databasen från webbplatsen HowBadIsMyBatch.com för det partinummer som det hänvisas till ovan (EL1484) hittades följande information.
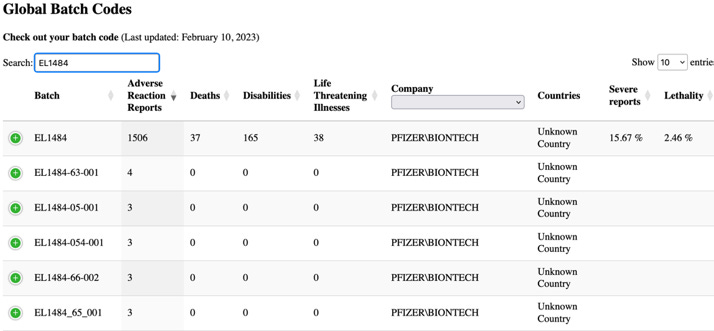
Nivån av allvarliga rapporter och dödlighet som härrör från detta parti är chockerande, men i EU-dokumentet tycks det inte finnas något ovanligt att rapportera.
Menstruationsstörningar
Vad som är intressant är att det i rapporten står : ”I den slutliga AR [assessment report] av den femte SMSR [summary monthly safety report] 1 april 2021- 29 april 2021, angavs att ett antal förfrågningar har inkommit om menstruationsstörningar, särskilt menorrhagia [långvarig blödning]. Detta är värt att undersöka ytterligare i den kommande PSUR, vilket kan vara en fråga som oroar unga kvinnor…”
Vidare står det att MAH [BioNTech] ombeds att i denna PSUR-granskning inkludera en separat ”utvärdering av fall efter marknadsintroduktion” av de fall som rapporterar menstruationsstörningar, vilket också bör inkludera en sub-analys av fall uppdelade på fall efter menopaus och fall av menstruationsstörningar. Kausalitetsbedömning bör tillhandahållas per fall för åtminstone de allvarliga fallen…”
Denna information påstods finnas i bilaga 6B.6 ”MENSTRUAL DISORDERS”

FOIA-utgåvan av denna PSUR innehöll dock inte någon av de viktiga bilagorna.
Slutsatsen av PSUR-utredningen om menstruationsstörningar är anmärkningsvärt avvisande och vad vissa skulle anse vara till och med stötande: ”Dessa är sannolikt förknippade med psykologisk oro och stress i samband med pandemin, viktökning, längre arbetstider och kostförändringar…”
En rapport som publicerades i British Medical Journal, strax efter det att denna PSUR godkändes, konstaterades att ”förändringar i menstruationer och oväntade vaginala blödningar inte nämns, men läkare inom primärvården och de som arbetar med reproduktiv hälsa kontaktas i allt större utsträckning av personer som har upplevt dessa händelser kort efter vaccinationen. Mer än 30 000 rapporter om dessa händelser hade gjorts till MHRA:s övervakningssystem för biverkningar av läkemedel fram till den 2 september 2021, för alla covid-19-vacciner som för närvarande erbjuds.”
I juli 2022 fanns dessutom en systematisk översikt tillgänglig online och publicerades i den vetenskapliga tidskriften ’Vacunas” med titeln: ” Menstruella avvikelser efter COVID-19-vacciner: En systematisk översikt.”
Sammanlagt 78 138 vaccinerade kvinnor ingick i översikterna från 14 studier. Det rapporterades att ”ett betydande antal kvinnor (52,05 % ) har upplevt menstruationsavvikelser efter COVID-19-vaccinet.”
Graviditetsutfall
En av de mest alarmerande datamängder jag stötte på hörde till denna kategori. Från och med våren 2021 började hälsomyndigheterna i de flesta utvecklade länder uppmuntra gravida och ammande kvinnor att ta det nya mRNA-vaccinet. De förödande uppgifterna i PSUR, som undertecknades sommaren 2021, borde ha fått dessa myndigheter att göra en abrupt helomvändning, men det gjorde de inte.

På grundval av ovanstående begäran från WHO undersökte MAH (BioNTech) resultatet av de graviditetsfall som observerats i data från de kliniska prövningarna. Tabell 39 nedan visar 26 graviditetsutfall av de 149 unika graviditetsfall som registrerades under rapporte-ringsintervallet. Av dessa 26 resultat resulterade 15 i spontan abort (missfall) och 5 av graviditetsfallen resulterade i levande födslar med medfödda anomalier.
Se tabellen nedan.
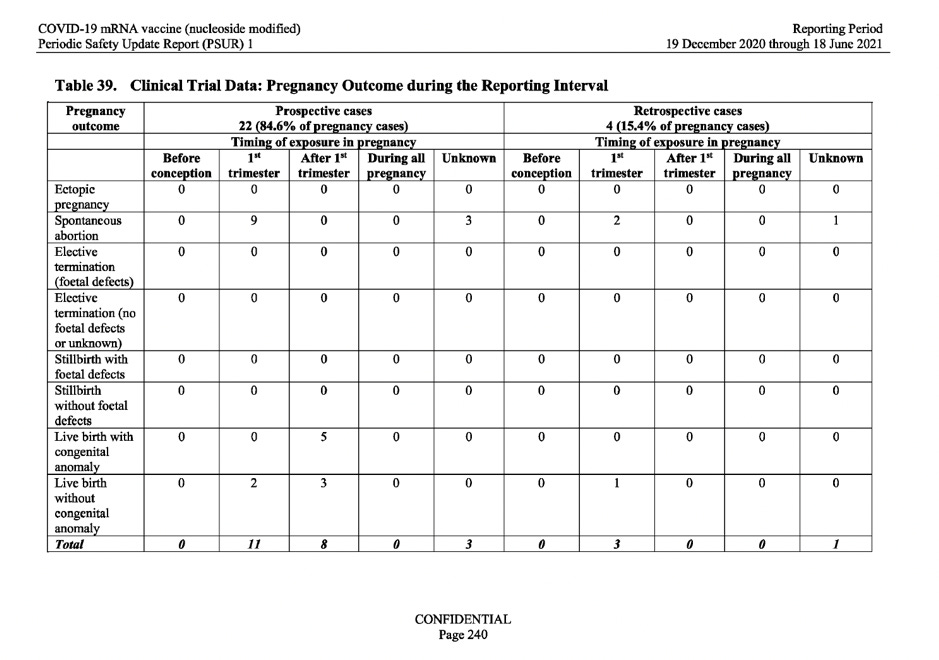
Som svar på dessa alarmerande uppgifter angavs i rapporten helt enkelt följande: ”Det fanns begränsad information om moderns obstetriska historia, vilket omöjliggjorde en meningsfull bedömning av orsakssamband .”
Dödsfall
När vi nu går över till datamängderna om dödsfall finns nedan en skärmdump som visar de vanligaste rapporterade dödsorsakerna från uppgifterna efter godkännandet.

Under rapporteringsintervallet råkade COVID-19 vara den främsta dödsorsaken (förutom ”Död” i sig själv) – just den sjukdom som vaccinet i stor utsträckning ansågs skydda mot. Lägg också märke till hur ”plötslig död” rapporterades som en av de vanligaste orsakerna. Många rapporter i de etablerade medierna (efter att COVID-19-vaccinet lanserades) har behandlat historier om unga och friska människor som plötsligt dör, vilket är alarmerande.
Märkligt nog tillhandahölls obduktionsrapporter endast för 189 fall av de 5042 fallen från uppgifterna efter godkännandet. Se resultaten i skärmdumpen nedan.

Lungemboli orsakas av en tromb som bildas i en stor ven, ofta i benen, lossnar och transporteras med blodomloppet till lungorna, där den sedan blockerar en av artärerna…. Detta var den vanligaste rapporterade sjukdomen i de tillhandahållna obduktionsresul-taten. Vad som är värt att notera är att den amerikanska livsmedels- och läkemedels-myndigheten (FDA) i juli 2021 kopplade samman Pfizer-BioNTech-vaccinet med fyra nya negativa händelser av intresse (AEI), och tillade att det dock inte fanns några bevis för ett orsakssamband. Lungemboli var bland dessa, tillsammans med akut hjärtinfarkt (hjärtattack), immun trombocytopeni (en blodsjukdom) och disseminerad intravaskulär koagulation (ett tillstånd där blodproppar bildas i hela kroppen).
Enligt PSUR:s slutsats om dödsfall: ”inga nya säkerhetssignaler har framkommit utifrån granskningen av dessa fall … säkerhetsövervakningen kommer att fortsätta.”
När det gäller immun trombocytopeni angavs följande i rapportens sammanfattning:

Det är häpnadsväckande hur den första EU-rapporten om säkerhetsövervakning av vaccinet COVID-19 från Pfizer-BioNTech, som var fylld med så fördömande uppgifter, passerade genom Europeiska läkemedelsmyndighetens radar utan att väcka oro, men i stället följde de slutsatsen: ”Fördel- och riskprofilen för BNT162b2 är fortfarande gynnsam.” Vid den tidpunkten fanns det inga långsiktiga säkerhetsdata som EMA kunde förlita sig på, men de data som de hade på kort sikt (kända sedan sommaren 2021) borde ha satt igång larmklockorna, men i stället erbjöds denna experimentella produkt till yngre åldersgrupper i befolkningen och så småningom till spädbarn så unga som 6 månader.
Med tanke på de skyhöga säkerhetssignaler som observerats i olika övervakningsprogram för vacciner efter marknadsintroduktion runt om i världen, de alarmerande resultaten i dokumenten från den kliniska prövningen av Pfizer-BioNTech, de läckta utvärderings-rapporterna från EMA och interna e-postmeddelanden samt de fördömande uppgifter som hittats i PSUR nr 1 – har alla fungerat som en katalysator för att skyndsamt lyfta fram alla andra viktiga farmakovigilanta rapporter.
Läkare och medicinska experter över hela Europa har nu begärt ytterligare rapporter med vederbörlig process – fler analyser kommer att presenteras allteftersom vi får tillgång till dem.
Suggest a correction


![Ljudinspelning läckt från AstraZeneca: Covid klassificerades som ett nationellt säkerhetshot av den amerikanska regeringen/DOD [försvardepartementet] den 4 februari 2020.](https://childrenshealthdefense.eu/wp-content/uploads/2024/02/AstraZeneca-COVID-19-Vaccine-777x544-1-768x538.jpg)




