Falha da EMA em puxar 19 golpes COVID mesmo que a relação risco-benefício tenha sido anulada
Relatório de segurança da UE sobre a vacina Pfizer-BioNTech mRNA revela dados condenatórios
É mais que tempo de responsabilizar a EMA e a Comissão Europeia e os seus parceiros cúmplices – a começar pela OMS e FDA, CDC – pelo seu incumprimento do dever de não protegerem a saúde pública, ignorando os sinais de segurança gritantes e apoiando-se na declaração obviamente errónea de que a vacina Pfizer-BioNTech COVID-19 “perfil de risco-benefício” continua a ser favorável Este relatório de segurança há muito existente, publicado em Agosto de 2021, serve como prova sólida de que as partes envolvidas na avaliação e decisão de permitir a comercialização das ‘vacinas’ da COVID-19 estavam cientes do impacto devastador que provocaram. Não só falharam no seu dever de avaliar correctamente as ‘vacinas’ do mRNA antes da aplicação em seres humanos, como continuam a ignorar os indicadores de segurança em mãos, causando danos e destruição incomensuráveis.
A sua recusa reiterada em respeitar os seus mandatos legais exige uma investigação de potenciais violações civis e penais e o processo de responsabilização de todos os envolvidos.
Orsolya Gyorffy, CHD Europa
Originalmente publicado pela CHD Europe em 19 de Fevereiro de 2023
Typos e resultados da gravidez modificados em 22 de Fevereiro de 2023

Relatório de segurança da UE sobre a vacina Pfizer-BioNTech mRNA revela dados condenatórios
O primeiro Relatório Periódico de Segurança da UE de 286 páginas(PSUR #1), abrangendo o período de 6 meses de 19 de Dezembro de 2020 a 18 de Junho de 2021, revela sinais de segurança condenáveis para a vacina Pfizer-BioNTech Covid-19 (COMIRNATY). Foi divulgada através de pedido FOIA de um leitor anónimo e fornecida ao blogue científico e político austríaco, TKP.
De acordo com a definição da Agência Europeia de Medicamentos: “Os PSUR são farmacovigilância documentos destinados a fornecer uma avaliação da relação risco-benefício de um medicamento em pontos de tempo definidos após a sua autorização. O objectivo do PSUR é apresentar uma análise abrangente e crítica da relação risco-benefício do produto, tendo em conta informações de segurança novas ou emergentes no contexto de informações cumulativas sobre riscos e benefícios”
Neste caso, é o MAH (Titular da Autorização de Comercialização), BioNTech SE, que está legalmente obrigado a submeter as PSUR à EMA, juntamente com uma taxa de candidatura. A EMA avalia então a informação encontrada no relatório para determinar se são identificados novos riscos ou se a relação risco-benefício se alterou.
Analisei exaustivamente documentos volumosos relacionados com a vacina Pfizer-BioNTech, este relatório foi um dos que mais levantou a sobrancelha, não apenas em relação aos dados de risco, mas a sua conclusão de que o “perfil de risco-benefício da BNT162b2 continua a ser favorável“
Os dados relativos à condenação
Segue-se um resumo do número total de casos (dados pós-comercialização e de ensaios clínicos) do período de 6 meses de relatório:

A tabela abaixo (extraída do documento) mostra o número de casos repartidos por: sexo, idade, país, gravidade do caso, resultado e presença de comorbidades.
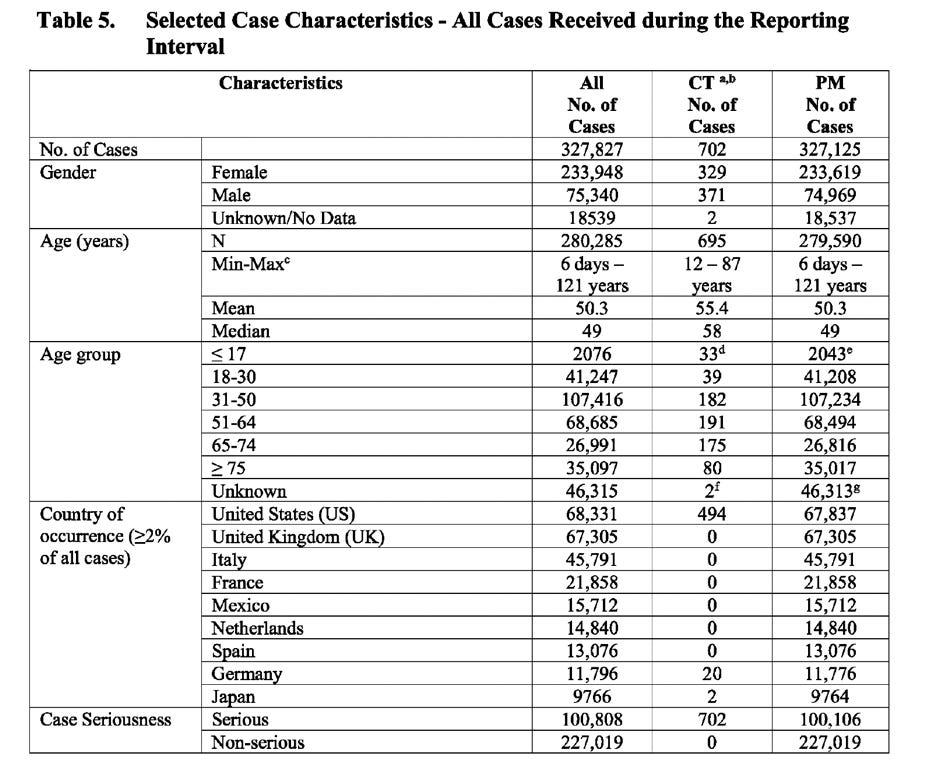
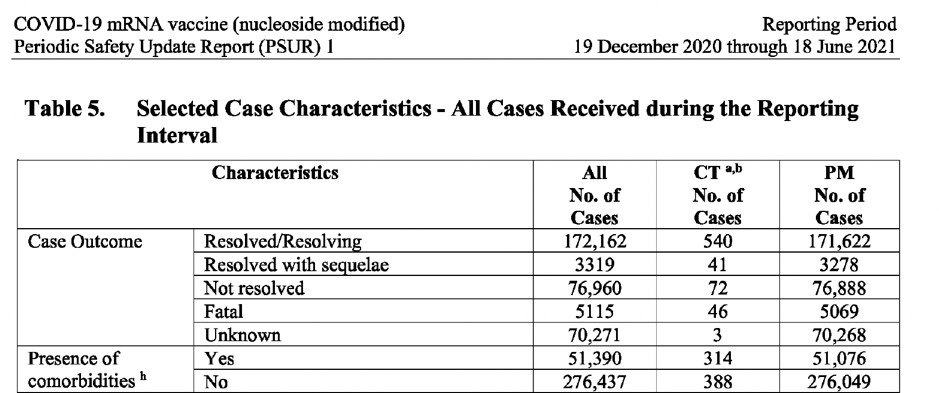
CT: Dados de ensaios clínicos PM: Dados de pós-comercialização
O que é digno de nota é que conclusões semelhantes relativas a: riscos de segurança de vacinas específicas para as mulheres; indivíduos (casos) que sofrem em média de 3-4 eventos adversos; elevado número de relatórios com resultados desconhecidos e/ou não resolvidos; elevado número de casos com o género desconhecido e o agrupamento invulgar de casos resolvidos/resolvidos foram encontrados quando analisei o documento preparado pela Pfizer para a FDA, intitulado, “Análise cumulativa de relatórios de eventos adversos pós-autorização de PF-0730202048 (BNT162B2) recebidos até 28 de Fevereiro de 2021“.
Contudo, uma diferença notável entre os dois relatórios, é a explosão no número de casos e eventos registados no PSUR da UE, que é sete vezes superior à apresentação da Pfizer à FDA, que cobriu metade do período.
O documento afirma que, durante o intervalo entre relatórios, foram administradas 635.763.682 doses a nível mundial e acrescenta: “Não é possível determinar com certeza o número de indivíduos que receberam BNT162b2 durante o período da presente revisão” Por conseguinte, não é possível extrapolar taxas de incidência precisas.
Contudo, um ponto importante a ter em conta na avaliação dos dados é a magnitude da subnotificação dos casos. Um estudo de Harvard concluiu que apenas 1-13% dos acontecimentos adversos graves são alguma vez notificados. Além disso, uma revisão sistemática por Hazell et al., forneceu “provas de uma significativa e generalizada subnotificação de RAM aos sistemas de notificação espontânea, incluindo RAM graves ou severas” Por conseguinte, é preocupante que, embora o número de casos e eventos no intervalo de notificação pareça elevado, os números reais possam ter sido muito mais elevados.
Os grupos etários mais jovens afectados, sem comorbidades
É um facto conhecido que a maioria das pessoas recupera totalmente após a contratação do Covid-19, particularmente aquelas sem comorbidades (sem problemas de saúde subjacentes) e que não são idosas. No entanto, o relatório do PSUR revela uma história alarmantemente diferente quando se trata dos receptores da vacina Pfizer-BioNTech: 23% dos casos das pessoas que sofreram de acontecimentos adversos após terem recebido a vacina, não recuperaram (ficaram por resolver) e em 21% dos casos, o resultado foi completamente desconhecido. Além disso, o número mais elevado de casos notificados registou-se no grupo etário 31-50, e não na população idosa. Ao analisar os dados pós-autorização para casos fatais, repartidos por presença/ausência de comorbilidades, em todos os grupos etários até 64 anos, ocorreram mais casos fatais em indivíduos sem comorbilidades. Dos indivíduos com 17 anos ou menos, morreram 22 indivíduos que não tinham comorbilidades, em comparação com 1 que tinha. Apenas no grupo etário com mais de 65 anos de idade é que o número de casos fatais com comorbilidades ultrapassa os sem comorbilidades. (Ver imagem de ecrã abaixo).
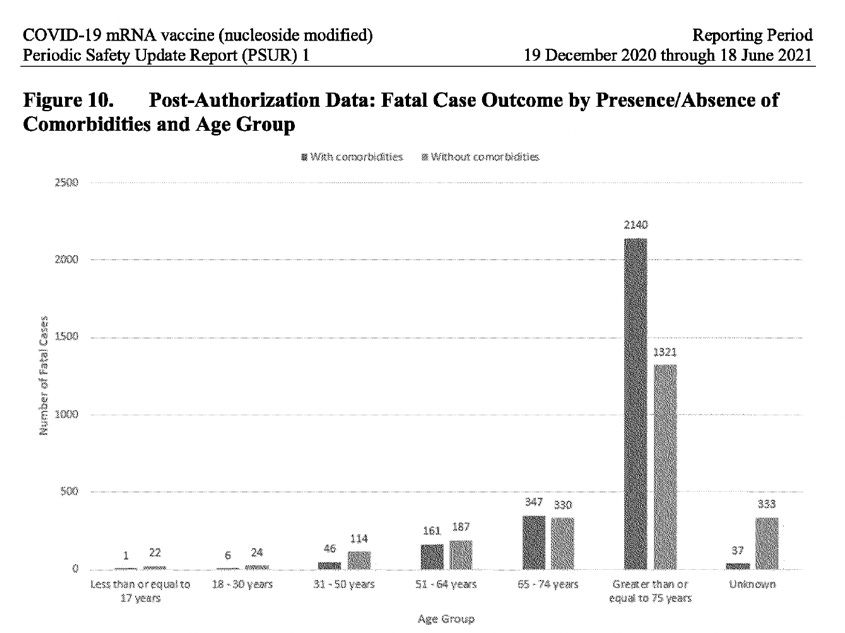
É altamente invulgar que o PSUR não tenha abordado este sinal de segurança óbvio que afecta os grupos etários mais jovens, mas que, em vez disso, o tenha ocultado dizendo “globalmente, a proporção de casos com um resultado fatal é ligeiramente mais elevada quando são relatadas comorbilidades”
O caso de Maddie de Garay
Ao analisar o relatório dos dados do ensaio clínico para o grupo etário dos 12-15 anos no documento, foi feita uma omissão óbvia, que pode ser descrita como a cobertura do caso de Maddie de Garay.
No início de 2022, entrevistei a mãe de Maddie de Garay, Stephanie. Maddie, na altura com 12 anos, participou no ensaio clínico da Pfizer/BioNTech para crianças de 12-15 anos de idade. Pouco depois de tomar a segunda dose, Maddie ficou com lesões que alteraram a sua vida, deixando-a imóvel e dependente de um tubo de alimentação. A mãe de Maddie disse-me em primeira mão que o principal investigador do ensaio adolescente de Pfizer, Dr. Robert Frenck, registou as lesões devastadoras da sua filha como “dor abdominal”, apesar de ele e os outros médicos do hospital de Cincinnati estarem cientes de todos os seus sintomas.
Repare como “dor abdominal” é um dos PTs (termos preferidos) em casos relevantes, referidos no ecrã abaixo, para os dados do ensaio clínico de crianças de 12-15 anos de idade.

O PSUR foi assinado pela Pessoa Qualificada para a Farmacovigilância da UE, Pfizer, Barbara de Bernardi, dois meses após a data de fecho do relatório de 18 de Junho de 2021. É invulgar como o CHMP da EMA recomendou a vacina Pfizer-BioNTech para crianças entre os 12-15 anos de idade, um mês antes da finalização do primeiro Relatório Periódico de Actualização de Segurança da UE, a 28 de Maio, com a EMA a aprová-la para esta subpopulação apenas alguns dias mais tarde. Porque não quiseram esperar por este importante documento de farmacovigilância que fornece uma avaliação da relação risco-benefício da vacina, antes de tomarem a sua decisão?
Os maus lotes
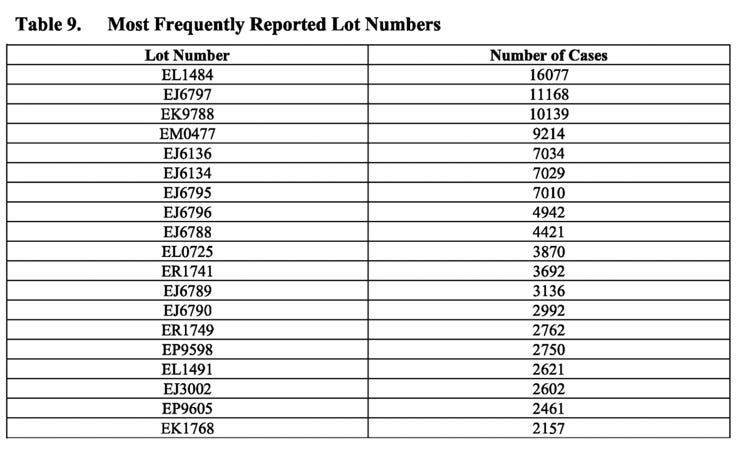
A tabela acima mostra os números de lote mais frequentemente reportados nos relatórios de casos. Note-se a frequência dos casos reportados para certos números de lote, como o número de lote EL1484, que foi reportado em 16.077 casos. No entanto, o PSUR prossegue afirmando “globalmente, não foram identificados problemas de qualidade relacionados durante as investigações destes números de lote/lotes… e quaisquer sinais potenciais que indicassem uma potencial relação entre um problema de segurança e um determinado lote, e que ainda não tenham sido avaliados como parte de outras actividades de sinais, seriam sujeitos a avaliação e escalonamento de acordo com os procedimentos padrão”
Esta afirmação é evasiva – mesmo o termo “global” implica que poderia ter havido questões relacionadas com a qualidade que foram identificadas através de diferentes lotes. De facto, sabia-se que o eram. Escrevi extensivamente sobre os e-mails da EMA e outros documentos relacionados com a Pfizer-BioNTech que revelaram que os reguladores tinham preocupações sobre a variação de lote para lote na qualidade da vacina até ao momento em que a autorização de utilização de emergência foi concedida. Nos lotes comerciais da vacina foram identificadas proporções significativamente mais elevadas de espécies truncadas de mRNA (não intactas), em comparação com as utilizadas nos ensaios clínicos. Estas espécies truncadas foram classificadas como “impurezas relacionadas com o produto”
Ao pesquisar a base de dados a partir do website, HowBadIsMyBatch.com, para o número de lote referenciado acima (EL1484)- foi encontrada a seguinte informação.
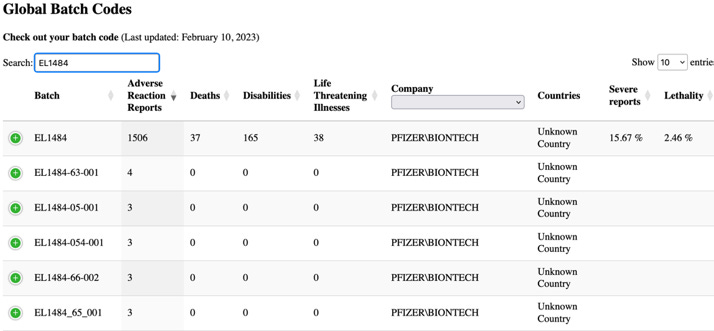
O nível de relatórios severos e de letalidade decorrente deste lote é chocante, no entanto, o documento da UE parece não encontrar nada de anormal para relatar.
Distúrbios Menstruais
O que é interessante é que o relatório afirma “No relatório final AR [relatório de avaliação] do5º SMSR [resumo do relatório mensal de segurança] 1 de Abril de 2021- 29 de Abril de 2021, foi declarado que foram recebidas várias perguntas sobre distúrbios menstruais, especialmente a menorragia [hemorragia prolongada]. Esta questão merece uma investigação mais aprofundada no próximo PSUR, que pode ser uma questão de preocupação para as mulheres jovens’
Prossegue, declarando que “o MAH [BioNTech] é solicitado a incluir nesta revisão do PSUR uma “avaliação de casos pós-comercialização” separada dos casos que relatam uma desordem menstrual, que deve também incluir uma sub-análise de casos divididos entre casos pós-menopausa e casos de desordens menstruais. A avaliação da causalidade deve ser fornecida por caso, pelo menos para os casos graves…’
Esta informação foi alegadamente fornecida no Apêndice 6B.6 ‘MENSTRUAL DISORDERS’

No entanto, a publicação FOIA deste PSUR não incluiu nenhum dos itens importantes do apêndice.
A conclusão da investigação do PSUR sobre distúrbios menstruais, é notavelmente desdenhosa e o que alguns considerariam até ofensivo: “Estes são susceptíveis de estar associados a angústia psicológica e stress relacionados com a pandemia, aumento de peso, horários de trabalho mais longos e alterações alimentares”..
Um relatório publicado no Jornal Médico Britânicopouco depois deste PSUR ter sido aprovado, declarou: “As alterações aos períodos e hemorragias vaginais inesperadas não estão listadas, mas os clínicos de cuidados primários e aqueles que trabalham na saúde reprodutiva são cada vez mais abordados por pessoas que experimentaram estes eventos pouco depois da vacinação. Mais de 30 000 relatórios destes eventos tinham sido feitos ao esquema de vigilância do cartão amarelo da MHRA para reacções adversas aos medicamentos até 2 de Setembro de 2021, em todas as vacinas covid-19 actualmente oferecidas”
Além disso, em Julho de 2022, uma revisão sistemática estava disponível online e publicada na revista científica vacunas intitulado: “Anomalias menstruais após vacinas COVID-19: Uma revisão sistemática”
Um total de 78.138 fêmeas vacinadas foram incluídas nas revisões de 14 estudos. Foi comunicado que “um número significativo de mulheres (52,05%) sofreu anomalias menstruais após a vacina COVID-19″
Resultados da gravidez
Um dos conjuntos de dados mais alarmantes com que me deparei, enquadrava-se nesta categoria. A partir da Primavera de 2021, as autoridades sanitárias da maioria das nações desenvolvidas começaram a encorajar as mulheres grávidas e lactantes a obter a nova vacina contra o mRNA. Os dados condenatórios no PSUR, que foi assinado até ao Verão de 2021, deveriam ter feito com que essas autoridades tivessem feito uma reviravolta abrupta, mas não o fizeram.

Com base no pedido acima referido da OMS, a MAH (BioNTech) analisou o resultado dos casos de gravidez observados nos dados do ensaio clínico. O quadro 39 abaixo, mostra 26 resultados de gravidez dos 149 casos únicos de gravidez, registados durante o intervalo de notificação. Desses 26 resultados, 15 resultaram em aborto espontâneo (aborto espontâneo) e 5 dos resultados da gravidez resultaram em nascidos vivos com anomalias congénitas.
Ver o quadro abaixo.
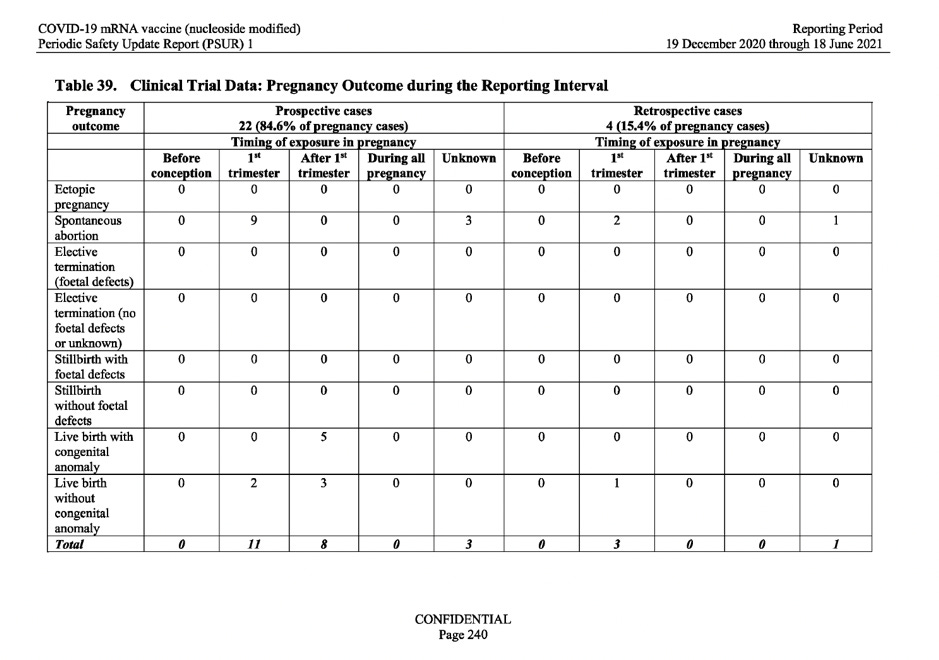
Em resposta a estes dados alarmantes, o relatório limitou-se a afirmar: “havia informações limitadas sobre a história obstétrica da mãe que impediam uma avaliação significativa da causalidade ”
Mortes
Voltando aos conjuntos de dados sobre mortes (resultados fatais), abaixo está uma imagem de ecrã mostrando as causas de morte mais frequentemente relatadas a partir dos dados pós-autorização.

Durante o período de intervalo de notificação, a COVID-19 foi a causa número um de mortes (além da própria “Morte”) – a própria doença contra a qual a vacina foi largamente tocada para se proteger. Note-se também como a ‘morte súbita’ foi relatada como uma das causas mais frequentes. Muitas reportagens nos principais meios de comunicação social (após o lançamento da vacina COVID-19) cobriram histórias de jovens e saudáveis, morrendo subitamente, o que é alarmante.
Estranhamente, relatórios de autópsia só foram fornecidos para 189 dos 5042 casos dos dados pós-autorização. Ver os resultados na imagem de ecrã abaixo.

A embolia pulmonar é causada por um trombo que se forma numa grande veia, muitas vezes nas pernas, desprende-se e é levada pela corrente sanguínea até aos pulmões, onde depois bloqueia uma das artérias. Esta foi a doença mais frequentemente notificada nos resultados da autópsia fornecida. O que vale a pena notar é que em Julho de 2021, a US Food and Drug Administration ligou a vacina Pfizer-BioNTech a quatro novos eventos adversos de interesse (AEI), acrescentando, no entanto, que não havia provas de uma ligação causal. A embolia pulmonar estava entre eles, juntamente com enfarte agudo do miocárdio (ataque cardíaco), trombocitopenia imune (uma doença do sangue), e a coagulação intravascular disseminada (uma condição em que se formam coágulos de sangue por todo o corpo).
Segundo a conclusão do PSUR sobre as mortes: “não surgiram novos sinais de segurança com base na revisão destes casos…a vigilância de segurança vai continuar”
No que respeita à trombocitopenia imunitária, o resumo executivo do relatório afirmava:

É espantoso como o primeiro relatório de farmacovigilância da UE para a vacina Pfizer-BioNTech COVID-19, carregada com tais dados condenatórios, navegou através do radar da Agência Europeia de Medicamentos, sem levantar quaisquer bandeiras vermelhas mas, em vez disso, foi a conclusão: “o perfil de risco-benefício da BNT162b2 continua favorável” Nessa altura, não havia dados de segurança a longo prazo em que a EMA pudesse confiar, contudo, os dados de que dispunham a curto prazo (conhecidos desde o Verão de 2021), deveriam ter enviado os sinais de alarme a tocar, só que não o fizeram, em vez disso este produto experimental foi oferecido a grupos etários mais jovens da população e, eventualmente, a bebés a partir dos 6 meses de idade.
Tendo em conta os sinais de segurança disparados observados em vários programas de vigilância pós-comercialização de vacinas em todo o mundo; as descobertas alarmantes nos documentos dos ensaios clínicos da Pfizer-BioNTech; os relatórios de avaliação da EMA e os e-mails internos, bem como os dados condenatórios encontrados no PSUR #1 – todos serviram de catalisador para trazer urgentemente à luz todos os outros relatórios farmacovigilantes importantes.
Médicos e peritos médicos em toda a Europa solicitaram agora mais relatórios com o devido processo – mais análises serão lançadas à medida que tivermos acesso.
Suggest a correction







