Eșecul EMA de a retrage COVID 19 jabs, chiar dacă raportul risc-beneficiu a fost anulat
Raportul de siguranță al UE privind vaccinul cu ARNm Pfizer-BioNTech dezvăluie date compromițătoare
A sosit momentul să tragem la răspundere EMA și Comisia UE și partenerii lor complici – începând cu OMS și FDA, CDC – pentru neglijența lor în a nu proteja sănătatea publică, ignorând semnalele de siguranță evidente și menținând declarația evident eronată că „profilul beneficiu-risc al vaccinului Pfizer-BioNTech COVID-19 rămâne favorabil” Acest raport de siguranță existent de mult timp, publicat în august 2021, servește drept dovadă solidă că părțile implicate în evaluarea și decizia de a permite introducerea pe piață a ‘vaccinurilor’ COVID-19 erau conștiente de impactul devastator pe care l-au adus. Nu numai că nu și-au îndeplinit datoria de a evalua în mod corespunzător ‘vaccinurile’ cu ARNm înainte de aplicarea pe oameni, dar continuă să ignore indicatorii de siguranță la îndemână, provocând daune și distrugeri nemăsurabile.
Refuzul lor repetat de a-și respecta mandatele legale necesită o investigație a posibilelor încălcări civile și penale și un proces de tragere la răspundere a tuturor celor implicați.
Orsolya Gyorffy, CHD Europe
Publicată inițial de CHD Europe la 19 februarie 2023
Tipărituri și rezultate de sarcină modificate la 22 februarie 2023

Raportul de siguranță al UE privind vaccinul cu ARNm Pfizer-BioNTech dezvăluie date condamnabile
Primul raport periodic actualizat de siguranță al UE (PSUR #1) de 286 de pagini, care acoperă perioada de 6 luni cuprinsă între 19 decembrie 2020 și 18 iunie 2021, relevă semnale de siguranță condamnabile pentru vaccinul Pfizer-BioNTech Covid-19 (COMIRNATY). Acesta a fost publicat prin intermediul unei cereri FOIA din partea unui cititor anonim și furnizat blogului austriac de știință și politică, TKP.
Conform definiției Agenției Europene pentru Medicamente: „PSUR-urile sunt documente de farmaco-vigilență destinate să ofere o evaluare a raportului risc-beneficiu al unui medicament la anumite momente de timp definite după autorizarea acestuia. Obiectivul PSUR este de a prezenta o analiză cuprinzătoare și critică a raportului risc-beneficiu al produsului, luând în considerare informațiile noi sau emergente privind siguranța în contextul informațiilor cumulative privind riscurile și beneficiile”
Deținătorul autorizației de introducere pe piață (MAH), în acest caz, BioNTech SE, este cel care are obligația legală de a trimite PSUR-uri la EMA, împreună cu o taxă de cerere. EMA evaluează apoi informațiile găsite în raport pentru a determina dacă sunt identificate riscuri noi sau dacă s-a modificat raportul risc-beneficiu.
Am parcurs îndelung documentele voluminoase legate de vaccinurile Pfizer-BioNTech, acest raport a fost unul dintre cele mai întrebătoare, nu doar în legătură cu datele condamnabile, ci și cu concluzia sa că „profilul beneficiu-risc al BNT162b2 rămâne favorabil„
Datele condamnabile
În cele ce urmează este prezentată o imagine de ansamblu a numărului total de cazuri (date ulterioare comercializării și date din studiile clinice) din perioada de raportare de 6 luni:

- 327,827 cazuri individuale raportate conținând 1,172,887 evenimente adverse
- De trei ori mai multe cazuri raportate pentru femei dacat barbati
- Cele mai multe cazuri raportate in grupa de varsta 31-50
- O treime din cazurile raportate au fost grave
- 44% din cazuri au fost clasificate cu rezultat nestiut sau nerezolvat
- 84% din cazuri nu au avut comorbidități
- 5115 decese aparute ca urmare a vaccinului
- 46% din cazurile cu evolutie fatala au aparut la cei care nu aveau comorbidități
Tabelul de mai jos (extras din document) prezintă numărul de cazuri defalcat după: sex, vârstă, țară, gravitatea cazului, rezultat și prezența comorbidităților.
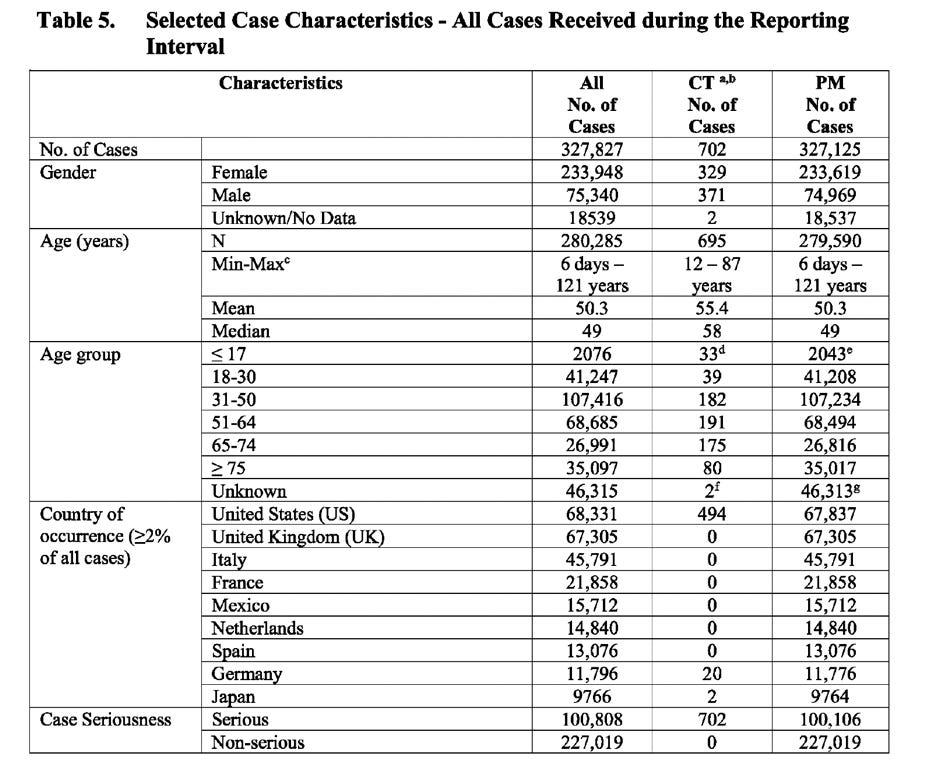
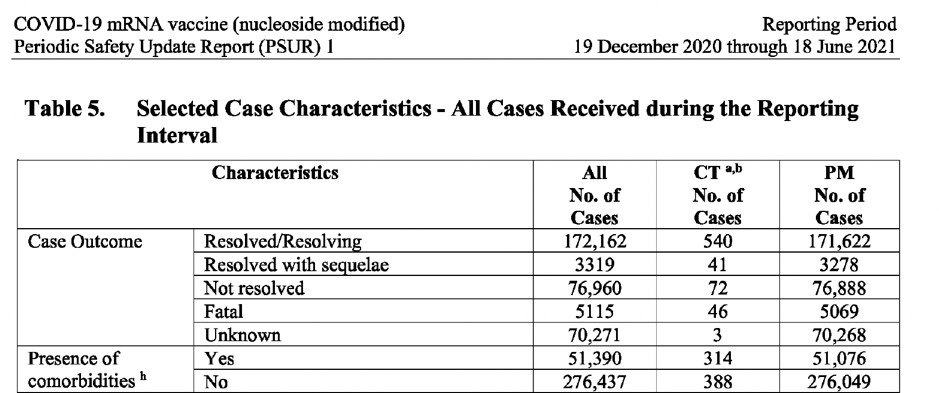
CT: Date din studiile clinice PM: Date postcomercializare
Ceea ce este demn de remarcat este faptul că constatări similare referitoare la: riscuri de siguranță a vaccinului specifice sexului feminin; persoane (cazuri) care suferă în medie de 3-4 evenimente adverse; număr mare de rapoarte cu rezultate necunoscute și/sau nerezolvate; număr mare de cazuri cu sex necunoscut și gruparea neobișnuită a cazurilor rezolvate/rezolvate, au fost constatate atunci când am analizat documentul pregătit de Pfizer pentru FDA, intitulat „Cumulative Analysis of Post-Authorization Adverse Event Reports of PF-07302048 (BNT162B2) received through 28 February 2021„.
Cu toate acestea, o diferență izbitoare între cele două rapoarte, este explozia numărului de cazuri și evenimente înregistrate în PSUR al UE, care este de șapte ori mai mare decât cel prezentat de Pfizer către FDA, care a acoperit jumătate din perioadă.
Documentul precizează că, în intervalul de raportare, se estimează că au fost administrate 635.763.682 de doze la nivel mondial și adaugă: „Nu este posibil să se determine cu certitudine numărul de persoane care au primit BNT162b2 în perioada acestei analize” Prin urmare, extrapolarea unor rate de incidență exacte nu este fezabilă.
Cu toate acestea, un aspect important de luat în considerare atunci când se evaluează datele, este amploarea subraportării cazurilor. Un studiu realizat la Harvard a concluzionat că doar 1-13% din evenimentele adverse grave sunt raportate vreodată. Mai mult, o analiză sistematică realizată de Hazell și colab. a furnizat „dovezi ale unei subraportări semnificative și răspândite a reacțiilor adverse la sistemele de raportare spontană, inclusiv a reacțiilor adverse grave sau severe” . Prin urmare, este îngrijorător faptul că, deși numărul de cazuri și evenimente din intervalul de raportare pare ridicat, este posibil ca cifrele reale să fi fost mult mai mari.
Grupele de vârstă mai tinere afectate, fără comorbidități
Este un fapt cunoscut faptul că majoritatea persoanelor se recuperează complet după ce au contractat Covid-19, în special cele fără comorbidități (fără probleme de sănătate subiacente) și care nu sunt în vârstă. Cu toate acestea, raportul PSUR dezvăluie o poveste alarmant de diferită atunci când vine vorba de beneficiarii vaccinului Pfizer-BioNTech: un procent uluitor de 23% din cazurile celor care au suferit evenimente adverse după administrarea vaccinului nu s-au recuperat (au rămas nerezolvate), iar pentru 21% dintre cazuri, rezultatul a fost complet necunoscut. De asemenea, cel mai mare număr de cazuri raportate a fost înregistrat la grupa de vârstă 31-50 de ani, nu la populația vârstnică. Atunci când se analizează datele post-autorizare pentru cazurile fatale, defalcate în funcție de prezența/absența comorbidităților, la toate grupele de vârstă de până la 64 de ani, mai multe cazuri fatale au apărut la persoanele fără comorbidități. Dintre persoanele cu vârsta de 17 ani și mai puțin, au murit 22 de persoane care nu prezentau comorbidități, comparativ cu 1 persoană care avea comorbidități. Doar la grupa de vârstă de peste 65 de ani se observă că numărul de cazuri fatale cu comorbidități le depășește pe cele fără comorbidități. (A se vedea captura de ecran de mai jos).
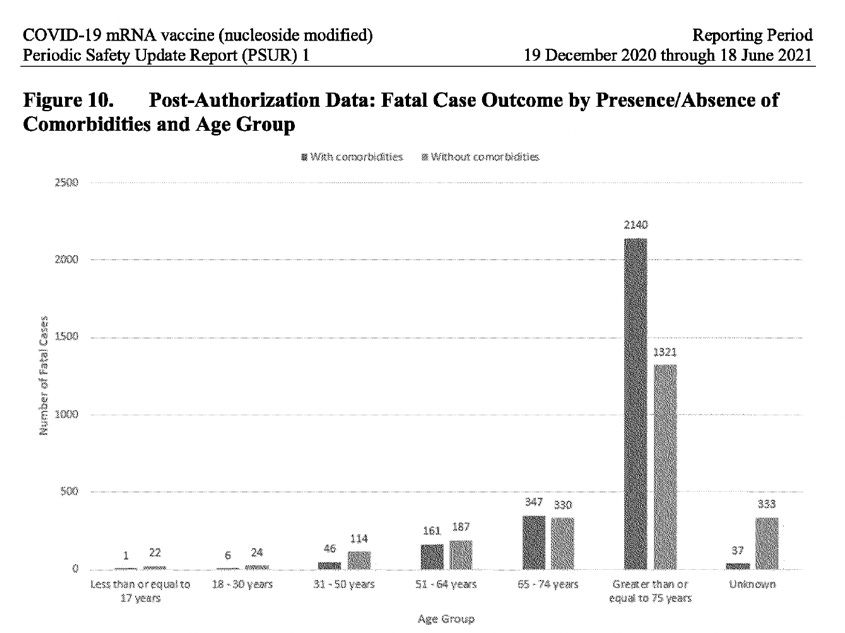
Este extrem de neobișnuit faptul că PSUR nu a abordat acest semnal de siguranță evident care afectează grupele de vârstă mai tinere, ci a trecut cu vederea spunând că „în general, proporția de cazuri cu un rezultat fatal este ușor mai mare atunci când sunt raportate comorbidități”
Cazul lui Maddie de Garay
Atunci când se analizează raportarea în document a datelor studiilor clinice pentru grupa de vârstă 12-15 ani, a fost făcută o omisiune evidentă, care poate fi descrisă ca fiind mușamalizarea cazului Maddie de Garay.
La începutul anului 2022, am intervievat-o pe mama lui Maddie de Garay, Stephanie. Maddie, în vârstă de 12 ani la momentul respectiv, a participat la studiul clinic al Pfizer/BioNTech pentru copiii cu vârste cuprinse între 12 și 15 ani. La scurt timp după ce a luat a doua doză, Maddie s-a ales cu leziuni care i-au schimbat viața, lăsând-o imobilizată și dependentă de un tub de alimentare. Mama lui Maddie mi-a povestit direct că principalul investigator al Pfizer pentru studiul clinic pentru adolescenți, Dr. Robert Frenck, a înregistrat leziunile devastatoare ale fiicei sale ca fiind „dureri abdominale”, deși el și ceilalți medici de la spitalul din Cincinnati erau conștienți de toate simptomele ei.
Observați cum „durere abdominală” este unul dintre PT (termenii preferați) în cazurile relevante, la care se face referire în captura de ecran de mai jos, pentru datele studiilor clinice pentru copii de 12-15 ani.

PSUR a fost semnat de către persoana calificată din UE pentru farmacovigilență, Pfizer, Barbara de Bernardi, la două luni după data limită de raportare, 18 iunie 2021. Este neobișnuit modul în care CHMP al EMA a recomandat vaccinul Pfizer-BioNTech pentru copiii cu vârste cuprinse între 12 și 15 ani, cu o lună înainte de finalizarea primului raport periodic actualizat privind siguranța din UE, la 28 mai, EMA aprobându-l pentru această subpopulație doar câteva zile mai târziu. De ce nu au vrut să aștepte ca acest document important de farmacovigilență care oferă o evaluare a raportului risc-beneficiu al vaccinului să fie publicat mai întâi, înainte de a lua o decizie?
Loturile rele
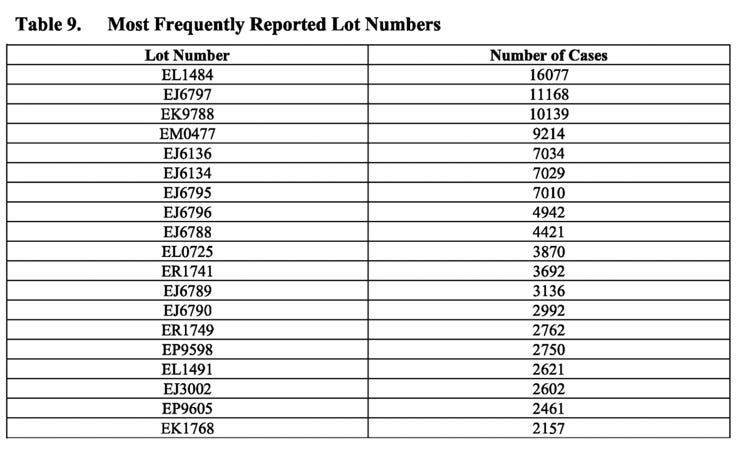
Tabelul de mai sus prezintă numerele de lot cel mai frecvent raportate în rapoartele de caz. Observați frecvența cazurilor raportate pentru anumite numere de lot, cum ar fi numărul de lot EL1484, care a fost raportat în 16.077 de cazuri. Cu toate acestea, PSUR continuă să afirme că „în general, nu au fost identificate probleme de calitate conexe în timpul investigațiilor acestor numere de loturi/loturi… și orice semnal potențial care indică o relație potențială între o problemă de siguranță și un anumit lot de loturi, și care nu a fost deja evaluat ca parte a altor activități de semnalare, va fi supus evaluării și escaladării conform procedurilor standard”
Această declarație este evazivă – chiar și termenul „global” implică faptul că ar fi putut exista probleme legate de calitate care au fost identificate în diferite loturi. De fapt, se știa că acestea erau. Am scris pe larg despre scurgerile de e-mailuri de la EMA și despre alte documente legate de Pfizer-BioNTech, care au dezvăluit că autoritățile de reglementare au avut preocupări cu privire la variația de la un lot la altul în ceea ce privește calitatea vaccinului chiar până în momentul în care a fost acordată autorizația de utilizare de urgență. Proporții semnificativ mai mari de specii de ARNm trunchiat (nu intact) au fost identificate în loturile comerciale ale vaccinului, în comparație cu cele utilizate în studiile clinice. Aceste specii trunchiate au fost clasificate drept „impurități legate de produs”
La căutarea în baza de date de pe site-ul web, HowBadIsMyBatch.com, pentru numărul de lot la care s-a făcut referire mai sus (EL1484)- au fost găsite următoarele informații.
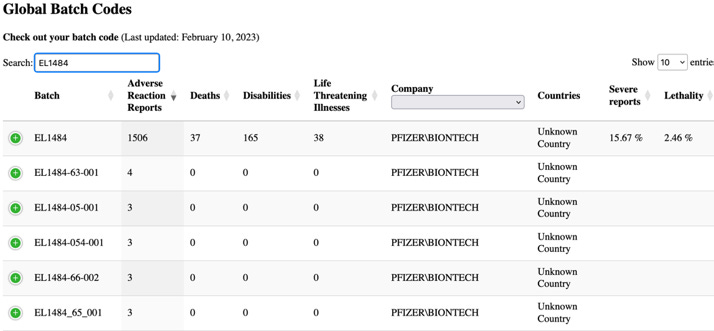
Nivelul rapoartelor grave și al letalității care decurg din acest lot este șocant, însă documentul UE pare să nu găsească nimic neobișnuit de raportat.
Tulburări menstruale
Ceea ce este interesant este că raportul afirmă: „În raportul final AR [raport de evaluare] al celui de-al 5-lea SMSR [raport lunar sumar de siguranță] 1 aprilie 2021- 29 aprilie 2021, s-a afirmat că s-au primit mai multe întrebări privind tulburările menstruale, în special menoragia [sângerări prelungite]. Această problemă merită o investigație suplimentară în viitorul PSUR, care poate fi o problemă de îngrijorare pentru femeile tinere…”
În continuare, se precizează că „MAH [BioNTech] este rugat să includă în această revizuire PSUR o „evaluare separată a cazurilor de postcomercializare” a cazurilor care raportează o tulburare menstruală, care ar trebui să includă, de asemenea, o subanaliză a cazurilor împărțite între cazurile de post-menopauză și cazurile de tulburări menstruale. Evaluarea cauzalității ar trebui să fie furnizată pentru fiecare caz în parte, cel puțin pentru cazurile grave…”
Aceste informații ar fi fost furnizate în apendicele 6B.6 „Tulburări menstruale”

Cu toate acestea, publicarea FOIA a acestui PSUR nu a inclus niciunul dintre elementele importante din anexă.
Concluzia investigației PSUR privind tulburările menstruale este remarcabil de disprețuitoare și ceea ce unii ar putea considera chiar jignitoare: „Este probabil ca acestea să fie asociate cu stresul și stresul psihologic legat de pandemie, creșterea în greutate, orele de lucru mai lungi și schimbările de regim alimentar…”
Un raport publicat în British Medical Journal, la scurt timp după ce acest PSUR a fost aprobat, a declarat: „Modificările menstruației și sângerările vaginale neașteptate nu sunt enumerate, dar medicii din asistența medicală primară și cei care lucrează în domeniul sănătății reproducerii sunt abordați din ce în ce mai des de persoane care au experimentat aceste evenimente la scurt timp după vaccinare. Mai mult de 30 000 de raportări ale acestor evenimente au fost făcute la sistemul de supraveghere a cartonașului galben al MHRA pentru reacții adverse la medicamente până la 2 septembrie 2021, pentru toate vaccinurile covid-19 oferite în prezent’
În plus, în iulie 2022, o analiză sistematică a fost disponibilă online și publicată în revista științifică ‘Vacunas’ intitulată: „Anomalii menstruale după vaccinurile COVID-19: O analiză sistematică
Un total de 78.138 de femele vaccinate au fost incluse în recenzii din 14 studii. Acesta a raportat că ‘un număr semnificativ de femei (52,05% ) au prezentat anomalii menstruale după vaccinul COVID-19′
Rezultatele sarcinii
Unul dintre cele mai alarmante seturi de date pe care le-am întâlnit, a intrat în această categorie. Din primăvara anului 2021, autoritățile sanitare din majoritatea țărilor dezvoltate au început să încurajeze femeile însărcinate și cele care alăptează să primească noul vaccin cu ARNm. Datele condamnabile din PSUR, care a fost semnat până în vara anului 2021, ar fi trebuit să determine aceste autorități să facă o întoarcere bruscă, dar nu a fost așa.

Pe baza solicitării de mai sus a OMS, MAH (BioNTech) a analizat rezultatul cazurilor de sarcină observate în datele studiilor clinice. Tabelul 39 de mai jos, prezintă 26 de rezultate ale sarcinii din cele 149 de cazuri înregistrate în timpul intervalului de raportare. Din aceste 26 de rezultate, 15 au dus la avort spontan (avort spontan) și 5 dintre rezultatele sarcinii au dus la nașteri vii cu anomalii congenitale.
A se vedea tabelul de mai jos.
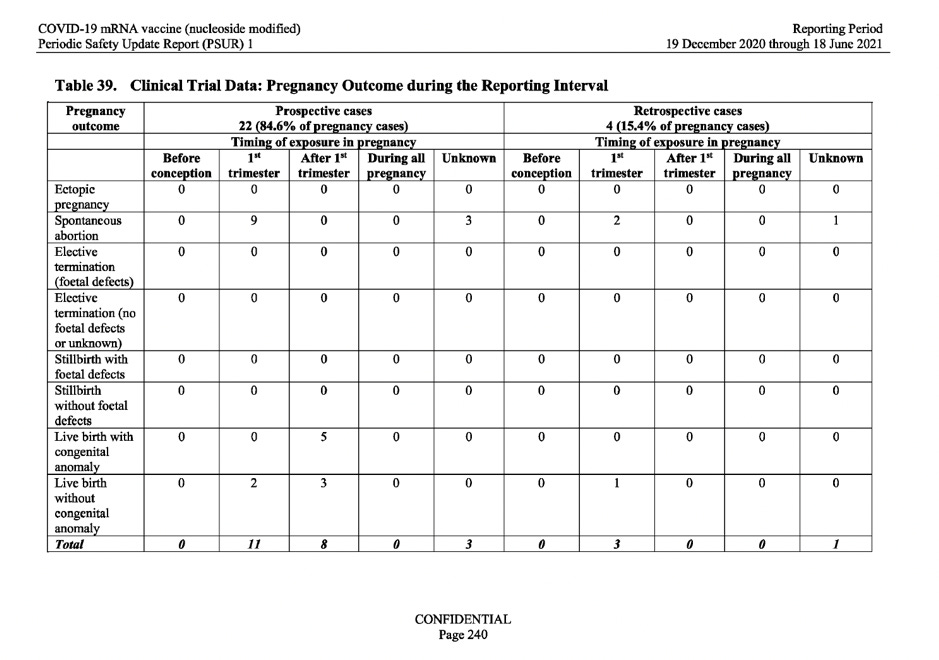
Ca răspuns la aceste date alarmante, raportul a afirmat pur și simplu: „existau informații limitate cu privire la istoricul obstetrical al mamei, ceea ce a împiedicat o evaluare semnificativă a cauzalității ”
Decese
Revenind la seturile de date privind decesele (rezultate fatale), mai jos este o captură de ecran care arată cele mai frecvent raportate cauze de deces din datele post-autorizare.

În perioada intervalului de raportare, s-a întâmplat ca COVID-19 să fie cauza numărul unu de deces (în afară de „decesul” în sine) – chiar boala împotriva căreia vaccinul a fost prezentat pe scară largă ca fiind protejat. Observați, de asemenea, cum „moartea subită”(sudden death) a fost raportată ca fiind una dintre cele mai frecvente cauze. Numeroase rapoarte din presa mainstream (după lansarea vaccinului COVID-19) au prezentat povești despre tineri sănătoși care au murit subit, ceea ce este alarmant.
În mod ciudat, rapoartele de autopsie au fost furnizate doar pentru 189 de cazuri din cele 5042 de cazuri din datele post-autorizare. Vedeți rezultatele în captura de ecran de mai jos.

Embolia pulmonară este cauzată de un tromb care se formează într-o venă mare, adesea la nivelul picioarelor, se desprinde și este transportat de fluxul sanguin până la plămâni, unde blochează una dintre artere. Aceasta a fost cea mai frecventă boală raportată în rezultatele autopsiei furnizate. Ceea ce este demn de remarcat este că, în iulie 2021, Administrația americană pentru Alimente și Medicamente a legat vaccinul Pfizer-BioNTech de patru noi evenimente adverse de interes (AEI), adăugând, totuși, că nu existau dovezi ale unei legături de cauzalitate. Embolia pulmonară se număra printre acestea, alături de infarctul miocardic acut (atac de cord), trombocitopenia imună (o tulburare de sânge) și coagularea intravasculară diseminată (o afecțiune prin care se formează cheaguri de sânge în tot corpul).
Conform concluziei PSUR privind decesele: „nu au apărut noi semnale de siguranță pe baza revizuirii acestor cazuri… supravegherea siguranței va continua”
În ceea ce privește trombocitopenia imună, în rezumatul executiv al raportului se precizează

Dupa DLP, trombocitopenia imuna a fost caracterizata fara risc, Nevralgia trigeminala si criza hipertensiva cu hemoragie intracraniana au foat considerate cu semnale nevalidate.
Este uluitor cum primul raport de farmacovigilență din UE pentru vaccinul Pfizer-BioNTech COVID-19, încărcat cu date atât de condamnabile, a trecut pe lângă radarul Agenției Europene pentru Medicamente, fără să ridice niciun semnal de alarmă, dar în schimb au mers mai departe cu concluzia: ‘profilul beneficiu-risc al BNT162b2 rămâne favorabil’ La acel moment, nu existau date de siguranță pe termen lung pe care EMA să se bazeze, însă datele pe care le aveau pe termen scurt (cunoscute din vara anului 2021), ar fi trebuit să tragă semnale de alarmă, numai că nu a fost așa, în schimb, acest produs experimental a fost oferit unor grupe de vârstă mai tinere ale populației și, în cele din urmă, bebelușilor cu vârsta de doar 6 luni.
Având în vedere semnalele de siguranță în creștere galopantă observate în cadrul diferitelor programe de supraveghere postcomercializare a vaccinurilor din întreaga lume; constatările alarmante din documentele studiilor clinice Pfizer-BioNTech; rapoartele de evaluare și e-mailurile interne ale EMA care au fost scurse, precum și datele condamnabile găsite în PSUR #1- toate au servit drept catalizator pentru a scoate urgent la lumină toate celelalte rapoarte farmacovigilente importante.
Medicii și experții medicali din întreaga Europă au solicitat acum alte rapoarte cu respectarea procedurilor legale – mai multe analize vor fi lansate pe măsură ce vom avea acces.
Suggest a correction







