Провалът на EMA да изтегли ваксините против Ковид 19, въпреки че балансът между риска и ползите се занули
Докладът на ЕС за безопасността на ваксината с иРНК на Pfizer-BioNTech разкрива компрометиращи данни
Крайно време е да се потърси отговорност от ЕМА и Комисията на ЕС и техните съучастници – като се започне със СЗО и FDA (Американската администрация по храните и лекарствата), CDC (Центъра за контрол на болестите) – за неизпълнението на задълженията им, като не са защитили общественото здраве, игнорирайки очевидните сигнали за безопасност и поддържайки очевидно погрешното твърдение, че „профилът полза-риск на ваксината Ковид-19 на Pfizer-BioNTech остава благоприятен“. Този отдавна съществуващ доклад за безопасност, публикуван през август 2021 г., служи като солидно доказателство, че страните, участващи в оценката и решението за допускане на „ваксините“ провтив Ковид-19 до пазара, са били наясно с опустошителното въздействие, което са предизвикали. Те не само не са изпълнили задължението си да оценят правилно иРНК „ваксинациите“ преди прилагането им върху хора, но и продължават да игнорират наличните показатели за безопасност, причинявайки неизмерими вреди и разрушения.
Многократният отказ на институциите да спазват законните си правомощия изисква разследване за нарушения и търсене на отговорност от всички замесени.
Орсоля Дьорфи, CHD Europe
Първоначално публикувано от CHD Europe на 19 февруари 2023 г.
Типовете и резултатите от бременността са променени на 22 февруари 2023 г.

Докладът на ЕС за безопасността на ваксината с иРНК на Pfizer-BioNTech разкрива унищожителни данни
Първият в историята на ЕС периодичен актуализиран доклад за безопасност(PSUR #1) от 286 страници, обхващащ 6-месечния период от 19 декември 2020 г. до 18 юни 2021 г., разкрива унищожителни сигнали за безопасността на ваксината Pfizer-BioNTech Covid-19 (COMIRNATY). Той беше публикуван чрез искане за FOIA (Закон за достъп до обществена информация) от анонимен читател и предоставен на австрийския научен и политически блог TKP.
Според определението на Европейската агенция по лекарствата: „PSUR са документи за фармакологична бдителност, които имат за цел да предоставят оценка на съотношението между риска и ползата от даден лекарствен продукт в определени моменти от време след разрешаването му за употреба. Целта на PSUR е да се представи цялостен и критичен анализ на съотношението риск-полза на продукта, като се вземе предвид нова или възникваща информация за безопасността в контекста на кумулативната информация за риска и ползите“.
По закон притежателят на разрешението за търговия (MAH) (в случая BioNTech SE) е този, който трябва да представи PSUR на EMA заедно с такса за кандидатстване. След това ЕМА оценява информацията, съдържаща се в доклада, за да определи дали са идентифицирани нови рискове или дали балансът риск-полза се е променил.
Обстойно съм преглеждала обемни документи, свързани с ваксините на Pfizer-BioNTech, като този доклад беше един от изненадващите, не само във връзка с изобличаващите данни, но и със заключението си, че „профилът полза-риск на BNT162b2 остава благоприятен„.
Покъртителните данни
По-долу е представен преглед на общия брой случаи (данни от постмаркетингови и клинични изпитвания) за 6-месечния период на докладване:

- 327,827 докладвани случая съдържащи 1,172,887 странични реакции;
- Три пъти повече случаи докладвани от жени, от колкото от мъже;
- Най-много случаи са докладвани от хора на възраст между 31-50 години;
- Една трета от случаите са класифицирани като сериозни
- 44% от докладваните случаи са с последици описани или като ‘неизвестни’ или ‘неразрешени’
- 84% от докладваните случаи нямат история на придружаващи заболявания
- 5115 смъртни случаи са посдледвали веднага след ваксинация
- 46% от докладваните смъртни случаи са при хора без придружаващи заболявания
Таблицата по-долу (извлечена от документа) показва броя на случаите, разпределени по: пол, възраст, държава, тежест на случая, изход и наличие на съпътстващи заболявания.
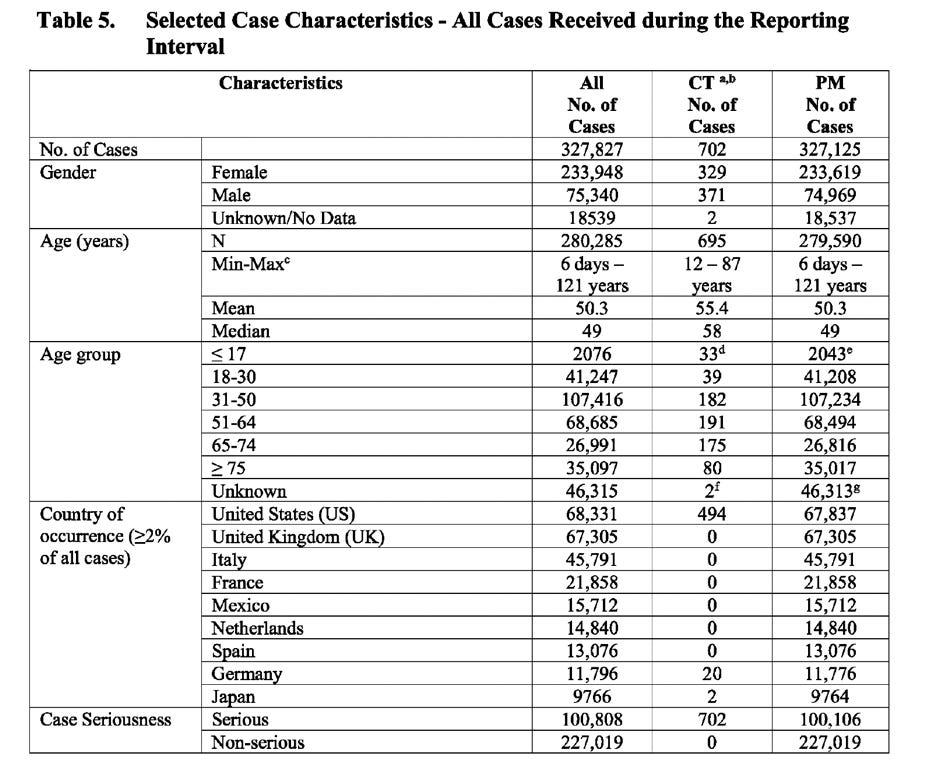
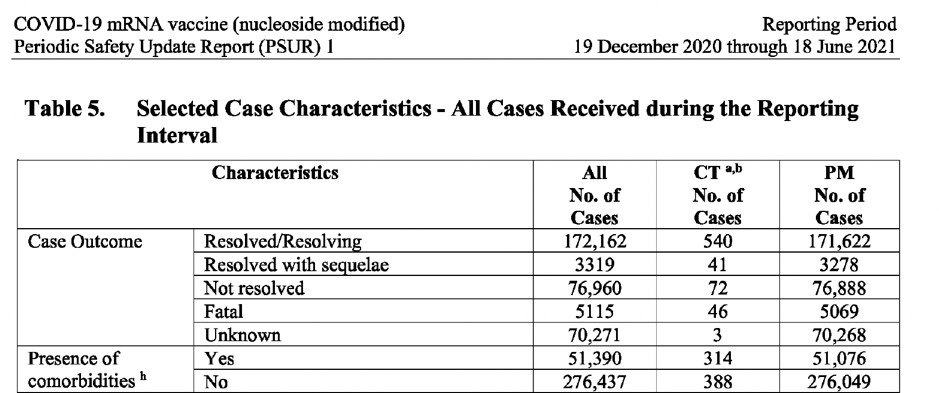
CT: Данни от клинични изпитвания PM: Данни след пускане на пазара
Това, което заслужава да се отбележи, е, че подобни констатации, свързани със: специфични за пола рискове за безопасността на ваксината при жените; лица (случаи), страдащи от средно 3-4 нежелани събития; голям брой доклади с неизвестни и/или неразрешени резултати; голям брой случаи с неизвестен пол и необичайно групиране на разрешени/разрешени случаи, бяха открити, когато анализирах документа, подготвен от Pfizer за FDA, озаглавен „Кумулативен анализ на докладите за нежелани събития след пускане на пазара на PF-07302048 (BNT162B2), получени до 28 февруари 2021 г.“.
Въпреки това, поразителната разлика между двата доклада, е експлозията в броя на случаите и събитията, регистрирани в PSUR на ЕС, който е зашеметяващо седем пъти по-голям в сравнение с подадения от Pfizer документ до FDA, който обхваща половината от периода.
В документа се посочва, че по време на отчетния интервал в световен мащаб са били приложени 635 763 682 дози, и се добавя: „Не е възможно да се определи със сигурност броят на лицата, които са получили BNT162b2 през периода на този преглед.“ Поради това екстраполирането на точни стойности на заболеваемостта е невъзможно.
Въпреки това, важен момент, който трябва да се вземе предвид при оценката на данните, е на недостатъчното съобщаване на случаите на странични ефекти от ваксините. Проучване на Харвард стига до заключението, че само 1-13% от сериозните нежелани събития са докладвани някога. Освен това систематичен преглед, извършен от Hazell и др., предоставя „доказателства за значително и широко разпространено недостатъчно докладване на нежелани реакции в системите за спонтанно докладване, включително на сериозни или тежки нежелани реакции“ Ето защо е обезпокоително, че въпреки че броят на случаите и събитията в интервала на докладване изглежда висок, действителният брой може да е бил много по-голям.
Засегнатите по-млади възрастови групи без съпътстващи заболявания
Известен факт е, че по-голямата част от хората се възстановяват напълно след заразяване с Ковид-19, особено тези без съпътстващи заболявания (без основни здравословни проблеми) и които не са в напреднала възраст. Докладът на PSUR обаче разкрива тревожно различна история, когато става въпрос за получателите на ваксината на Pfizer-BioNTech: зашеметяващите 23% от случаите на пострадали от нежелани събития след получаване на ваксината, не са се възстановили (останали са неразрешени), а за 21% от случаите изходът е бил напълно неизвестен. Освен това най-големият брой докладвани случаи е бил във възрастовата група 31-50 години, а не сред възрастното население. При анализ на данните за случаите с фатален изход, получени след издаване на разрешението за употреба, разпределени по наличие/отсъствие на съпътстващи заболявания, във всички възрастови групи до 64 години, повече случаи с фатален изход са възникнали при лица без съпътстващи заболявания. От лицата на възраст до 17 години са починали 22 лица, които не са имали съпътстващи заболявания, в сравнение с 1 лице, което е имало такива. Само във възрастовата група над 65 години броят на фаталните случаи със съпътстващи заболявания изпреварва тези без такива. (Вижте снимката по-долу).
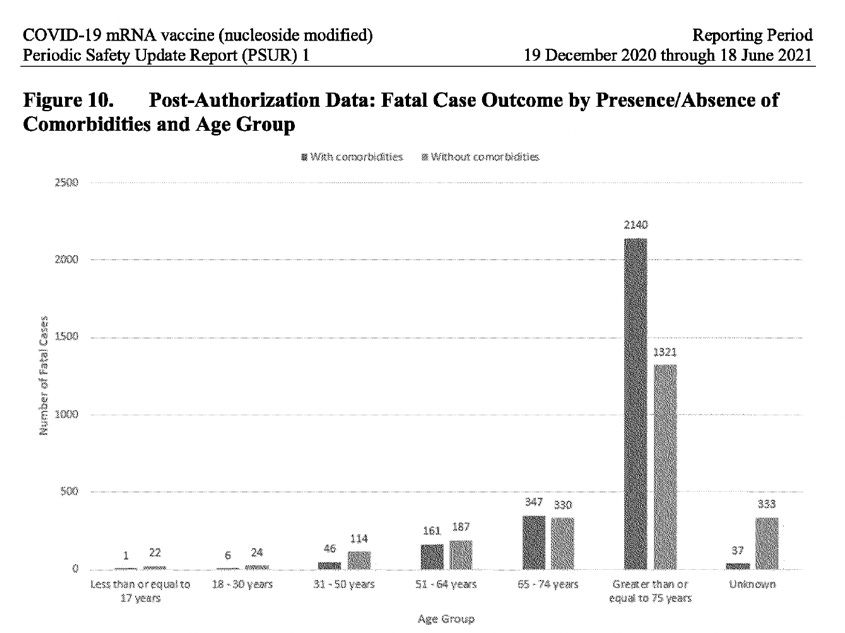
Изключително необичайно е, че в PSUR не е разгледан този очевиден сигнал за безопасност, засягащ по-младите възрастови групи, а вместо това е премълчан, като е казано, че „като цяло делът на случаите с фатален изход е малко по-висок, когато са съобщени съпътстващи заболявания“
Случаят на Мади де Гарай
При разглеждане на данните от клиничните изпитвания за възрастовата група от 12 до 15 години в документа е направен очевиден пропуск, който може да се опише като прикриване на случая на Мади де Гарай.
В началото на 2022 г. интервюирах майката на Мади де Гарай (Maddie de Garay), Стефани. Мади, която по това време е на 12 години, участва в клиничното изпитване на Pfizer/BioNTech за деца на възраст 12-15 години. Малко след като приема втората доза, Мади получава увреждания, които променят живота ѝ. Тя остава неподвижна и зависима от система за хранене. Майката на Мади ми разказа от първо лице, че главният изследовател на изпитването при юноши на Pfizer, д-р Робърт Френк (Robert Frenck), е записал опустошителните увреждания на дъщеря ѝ като „болки в корема“, въпреки че той и другите лекари от болницата в Синсинати са били наясно с всички нейни симптоми.
Обърнете внимание как „коремна болка“ е един от ПТ (предпочитаните термини) в съответните случаи, посочени в снимката на екрана по-долу, за данните от клиничните изпитвания за 12-15-годишни деца.

PSUR е подписан от Барбара де Бернарди (Barbara de Bernardi), квалифицирано лице по фармакологична бдителност в ЕС от Pfizer, два месеца след крайната дата за докладване 18 юни 2021 г. Необичайно е как CHMP (Комитет по лекарствените продукти за хуманна употреба) на EMA препоръчва ваксината на Pfizer-BioNTech за деца на възраст 12-15 години, месец преди финализирането на първия в историята на ЕС периодичен актуализиран доклад за безопасност, на 28 май, като EMA я одобрява за тази група от населението само няколко дни по-късно. Защо не пожелаха да изчакат първо да излезе този важен документ за фармакологична бдителност, съдържащ оценка на съотношението между риска и ползата от ваксината, преди да вземат решението си?
Лошите партиди
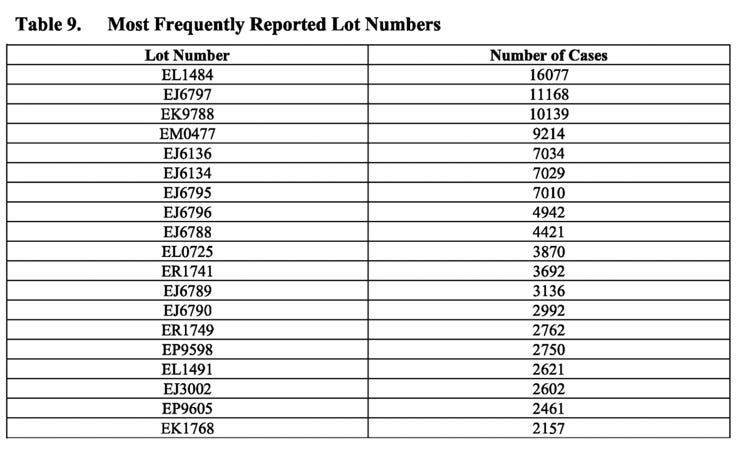
Таблицата по-горе показва най-често съобщаваните номера на партиди в докладите за случаи. Обърнете внимание на честотата на случаите, докладвани за определени партидни номера, като например партиден номер EL1484, за който са докладвани 16 077 случая. Въпреки това PSUR продължава да твърди, че „като цяло не са установени свързани проблеми с качеството по време на разследванията на тези партиди/номера на партиди… и всеки потенциален сигнал, показващ потенциална връзка между проблем с безопасността и конкретна партида, и който вече не е бил оценен като част от други дейности по сигнала, ще бъде подложен на оценка и ескалация съгласно стандартните процедури“.
Това изявление е уклончиво – дори терминът „като цяло“ предполага, че е възможно да е имало проблеми, свързани с качеството, които са били идентифицирани в различни партиди. Всъщност е било известно, че такива има. Писала съм подробно за изтеклите имейли на ЕМА и други документи, свързани с Pfizer-BioNTech, които разкриват, че регулаторните органи са имали опасения относно разликите в качеството на ваксината между отделните партиди до момента на издаване на разрешението за спешна употреба. В търговските партиди на ваксината е установен значително по-висок дял на съкратени видове иРНК (разкъсани) в сравнение с тези, използвани в клиничните изпитвания. Тези съкратени видове бяха класифицирани като „примеси, свързани с продукта“.
При търсене в базата данни от уебсайта HowBadIsMyBatch.com за посочения по-горе номер на партидата (EL1484) беше намерена следната информация.
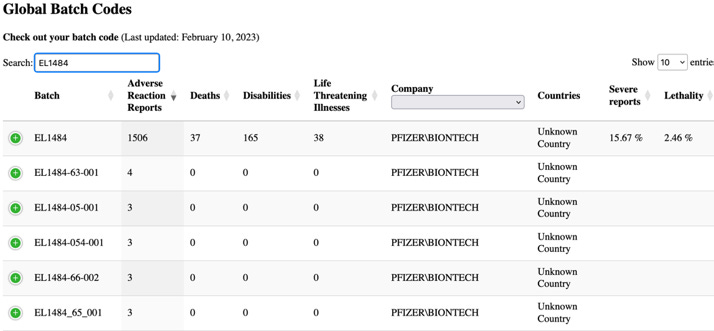
Равнището на тежките доклади и смъртността, произтичащи от тази партида, е шокиращо, но в документа на ЕС изглежда не се открива нищо необичайно, което да се докладва.
Менструални смущения
Интересното е, че в доклада се посочва: „В окончателния AR [доклад за оценка] на петия SMSR [обобщен месечен доклад за безопасност] 1 април 2021 г. – 29 април 2021 г. се посочва, че са получени редица запитвания за менструални нарушения, особено за менорагия [продължително кървене]. Този въпрос заслужава по-нататъшно проучване в предстоящия PSUR, което може да е въпрос, който да предизвиква загриженост у младите жени.“
След това се посочва, че „от MAH [BioNTech] се изисква да включи в този преглед на PSUR отделна „оценка на случаите след пускане на пазара“ на случаите, съобщаващи за менструално разстройство, която да включва и поданализ на случаите, разделени между случаите след менопауза и случаите с менструално разстройство. Оценката на причинно-следствената връзка следва да бъде представена за всеки отделен случай поне за сериозните случаи.“
Твърди се, че тази информация е предоставена в допълнение 6Б.6 „МЕНСТРУАЛНИ НАРУШЕНИЯ“

Въпреки това, публикуването на FOIA (Закон за достъп до обществена информация) на този PSUR не включва нито един от важните елементи на приложението.
Заключението на разследването на PSUR относно менструалните нарушения е забележително пренебрежително и според някои дори обидно: „Те вероятно са свързани с психологически стрес и напрежение, свързани с пандемията, увеличаване на теглото, по-дълго работно време и промени в диетата.“
Доклад, публикуван в сп British Medical Journal, малко след като този PSUR е одобрен, се посочва: „Промените в менструацията и неочакваното вагинално кървене не са изброени, но към лекарите от първичната медицинска помощ и работещите в областта на репродуктивното здраве все по-често се обръщат хора, които са преживели тези събития скоро след ваксинацията. До 2 септември 2021 г. в схемата за наблюдение на нежелани лекарствени реакции „жълта карта“ на MHRA са подадени над 30 000 съобщения за тези събития, отнасящи се за всички предлагани понастоящем ваксини против Ковид-19.„
Освен това през юли 2022 г. систематичен преглед е достъпен онлайн и е публикуван в научното списание „Vacunas озаглавен: „Менструални аномалии след ваксини Ковид-19: Систематичен преглед“.
В прегледа са включени общо 78 138 ваксинирани жени от 14 проучвания. В него се съобщава, че „значителен брой жени (52,05 % ) са имали менструални аномалии след ваксината против Ковид-19″.
Резултати от бременността
Един от най-тревожните набори от данни, на които попаднах, спада в тази категория. От пролетта на 2021 г. здравните власти в повечето развити страни започнаха да насърчават бременните и кърмещите жени да си поставят новата иРНК ваксина. Ужасяващите данни в PSUR, който беше подписан до лятото на 2021 г., би трябвало да накарат тези органи да направят рязък завой, но това не се случи.

Въз основа на горепосоченото искане на СЗО, MAH (BioNTech) разгледа резултата от случаите на бременност, наблюдавани в данните от клиничните изпитвания. В таблица 39 по-долу са показани 26 резултата от бременност от 149 уникални случая на бременност, регистрирани през отчетния интервал. От тези 26 резултата 15 са довели до спонтанен аборт (помятане), а 5 от случаите на бременност са довели до раждане на живо дете с вродени аномалии.
Вижте таблицата по-долу.
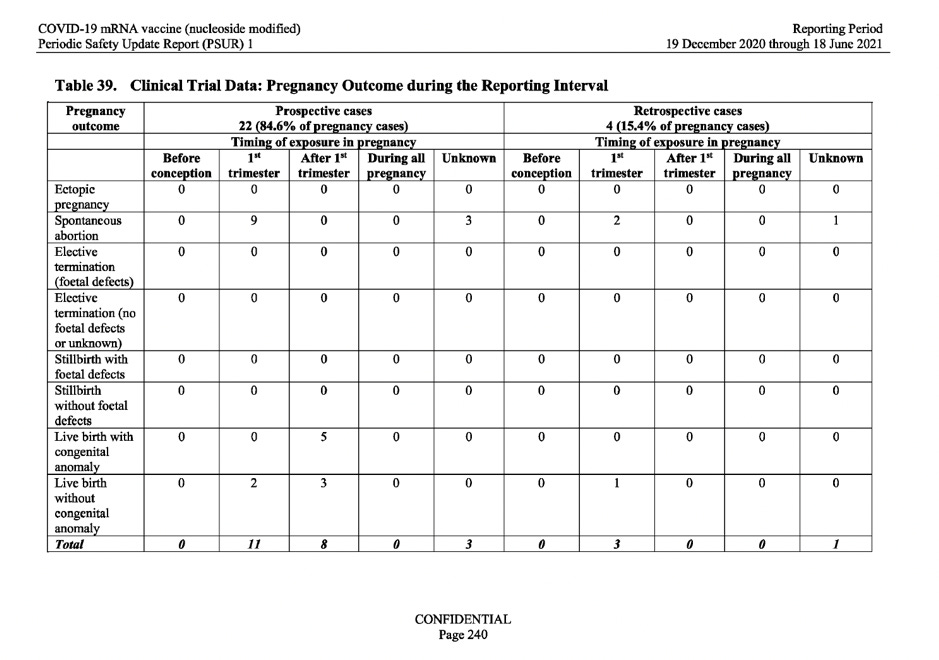
В отговор на тези тревожни данни в доклада просто се посочва: „информацията за акушерската история на майката е ограничена, което не позволява да се направи значима оценка на причинно-следствената връзка „.
Смъртни случаи
Преминавайки към наборите от данни за смъртни случаи (фатални резултати), по-долу е представена снимка, показваща най-често съобщаваните причини за смърт от данните след издаване на разрешението за търговско ползване.

През периода на отчетния интервал Ковид-19 се оказва причина номер едно за смърт (освен самата „смърт“) – самото заболяване, от което ваксината е широко рекламирана като защита. Забележете също така как „внезапната смърт“ е отчетена като една от най-честите причини. В много репортажи в основните медии (след пускането на ваксината Ковид-19) са описани истории за внезапна смърт на млади и здрави хора, което е тревожно.
Странно е, че доклади за аутопсия са предоставени само за 189 случая от общо 5042 случая от данните след разрешаването. Вижте резултатите на скрийншота по-долу.

Белодробната емболия се причинява от тромб, който се образува в голяма вена, често в краката, отделя се и се пренася от кръвния поток до белите дробове, където блокира една от артериите. Това е най-често съобщаваното заболяване в предоставените резултати от аутопсията. Това, което си струва да се отбележи, е, че през юли 2021 г. Американската администрация по храните и лекарствата (FDA) свърза ваксината на Pfizer-BioNTech с четири нови нежелани събития от интерес (НСЗИ), като добави обаче, че няма доказателства за причинно-следствена връзка. Сред тях е белодробната емболия, заедно с остър инфаркт на миокарда (сърдечен удар), имунна тромбоцитопения (нарушение на кръвта) и дисеминирана интравазална коагулация (състояние, при което се образуват кръвни съсиреци в цялото тяло).
Според заключението на PSUR относно смъртните случаи: „въз основа на прегледа на тези случаи не се появиха нови сигнали за безопасност… наблюдението на безопасността ще продължи“.
Що се отнася до имунната тромбоцитопения, в резюмето на доклада се посочва:

Удивително е как първият в ЕС доклад за фармакологична бдителност за ваксината против Ковид-19 на Pfizer-BioNTech, пълен с толкова изобличаващи данни, е преминал през радара на Европейската агенция по лекарствата (EMA), без да повдигне никакви червени флагове, а вместо това те са се съгласили със заключението: „профилът полза-риск на BNT162b2 остава благоприятен „. По това време ЕМА не разполагаше с дългосрочни данни за безопасност, на които да разчита, но данните, с които разполагаше в краткосрочен план (известни от лятото на 2021 г.), би трябвало да предизвикат алармен звън, само че това не се случи, а вместо това този експериментален продукт беше предложен на по-млади възрастови групи от населението и в крайна сметка на бебета на възраст едва 6 месеца.
Като се имат предвид рязко нарастващите сигнали за проблеми с безопасността, наблюдавани в различни програми за постмаркетингово наблюдение на ваксини по света; тревожните констатации в документите за клинични изпитвания на Pfizer-BioNTech; изтеклите доклади за оценка на EMA и вътрешни имейли, както и изобличаващите данни, открити в PSUR № 1 – всичко това служи за катализатор за спешно изкарване на бял свят на всички други важни фармакологични доклади.
Лекари и медицински експерти в цяла Европа вече са поискали допълнителни доклади с надлежна процедура – повече анализи ще бъдат разгърнати, когато получим достъп до съответните документи.
Suggest a correction







