COVID-19 mRNA-vacciner innehåller alltför stora mängder bakteriellt DNA: bevis och konsekvenser
Nya studier gjorda av Kevin McKernan, en ledande expert på DNA- och RNA-sekvenseringsmetoder, avslöjar att batcher av modifierat mRNA-vaccin, tillverkade av såväl Pfizer som Moderna, innehåller en stor andel kontaminerande bakteriellt DNA. Totalt sett uppgår DNA upp till 20-35 procent av nukleinsyrorna i varje vaccinparti. Dessa alarmerande höga koncentrationer överskrider vida de nivåer som anses säkra av standardiseringsorganisationer som Europeiska läkemedelsmyndigheten (EMA). Denna artikel summerar bevisen för denna DNA-kontaminering och diskuterar möjliga hälsorisker detta innebär för vaccinerade.
1. DNA:s roll vid tillverkning av mRNA-vaccin
1.1. Allmän bakgrund
De flesta läsare känner till att
- syntetiskt RNA som ingår i COVID-19 mRNA-vaccin kodar för SARS-CoV-2 spikprotein;
- instruktioner för att bygga en viss proteinmolekyl lagras som en gen i DNA kärnan hos levande däggdjursceller;
- för att bygga en viss proteinmolekyl transkriberar cellen först genen till RNA och modifierar de två ändarna av denna molekyl för att bilda messenger RNA (mRNA). Detta MRNA transporteras sedan från kärnan till cytoplasman, där det får cellens proteinfabriker – ribosomerna – att översätta nukleotidsekvensen i mRNA:t till motsvarande aminosyrasekvens och bygga ihop proteinet.
1.2. Steg i tillverkningen av mRNA-vaccin
Eftersom spikproteinet är en stor molekyl, är även det mRNA som kodar för det stort. Total syntes av stora mRNA-molekyler är inte praktiskt genomförbart i stor skala. För att få fram den spikkodande mRNA-molekylen efterliknas därför in vitro den process genom vilken cellen producerar sitt eget mRNA. Detta innebär följande steg:
- En DNA-kopia av spikproteinets gen sätts in i en bakterie plasmid. Detta är en ringformad, dubbelsträngad DNA-molekyl som kan existera i en bakteriecell oberoende av cellens eget kromosomala DNA och som också kan kopieras och överföras till båda dottercellerna när cellen delar sig.
- Den rekombinanta (konstgjorda) plasmid som bär på spikproteingenen introduceras i en cell av bakteriearten Escherichia coli(E. coli ). Eftersom E. coli-celler delar sig mycket snabbt kan denna enda cell på kort tid växa till ett mycket stort antal celler. Var och en av dessa progenitorceller kommer att innehålla sina egna nedärvda kopior av plasmidet och därmed genen för spikproteinet. Även om det finns en viss risk för att plasmiden kommer att försvinna från en del av avkomman, kan vi tvinga att den bibehålls genom att ge den en selekterbar markör som garanterar att endast de celler som behåller plasmiden överlever. I de plasmider som används av både Pfizer och Moderna är denna selekterbara markör en gen som ger värdcellerna resistens mot antibiotikan kanamycin. För att tillämpa selektion odlas bakterierna helt enkelt i kanamycin.
- Efter att ha odlat ett tillräckligt antal bakterieceller i en näringsbuljong som innehåller kanamycin bryts cellerna ner och plasmid-DNA renas från övriga komponenter i bakteriecellerna.
- De ringformade plasmidmolekylerna omvandlas till linjär form med hjälp av ett restriktionsenzym, som klyver DNA-molekylens båda strängar vid en specifik, unik plats längs spikproteingenen. Detta är nödvändigt för att förhindra att det bildas för långa RNA-molekyler som kan ge oönskade effekter in vivo. De linjäriserade DNA-molekylerna kan renas från de återstående cirkulära molekylerna, men hur och hur effektivt detta kan göras vid produktionen av Pfizers och Moderns vacciner är inte känt offentligt.
- Ett RNA-polymeras används,tillsammans med nödvändiga nukleosidbyggstenar och samfaktorer, för att kopiera spikproteingenen från DNA-versionen på den linjäriserade plasmiden till mRNA-versionen. Både Pfizer och Moderna använder T7 RNA-polymeras, som kommer från bakteriofagen med samma namn. Detta enzym binder sig till en motsvarande promotorsekvens, som också härrör från T7, och som har konstruerats i plasmidet från genen för spikproteinet. Interaktionen mellan polymeraset och promotorn initierar överföringen. I detta skede inkorporeras den syntetiska nukleosiden N-metyl-pseudouridin (mψU) i det konstgjorda RNA:t i stället för den naturliga uridin nukleosiden. När det administreras i vaccinform är RNA som modifierats på detta sätt mindre stimulerande för det medfödda immunsystemet än RNA som innehåller det naturliga uridinet. Det omvandlas också mer effektivt till protein och är under vissa förhållanden mer motståndskraftigt mot nedbrytning[1]. Både Pfizers och Modernas mRNA-vacciner innehåller mψU i stället för uridin.
- De två ändarna av varje RNA-molekyl är enzymatiskt kopplade till vissa delar som också finns på samma positioner i naturligt mRNA från däggdjur och som ökar deras biologiska aktivitet och stabilitet in vivo.
Dessa steg ger ett funktionellt mRNA som kan instruera cellernas ribosomer att producera spikproteinet. I detta skede är produkten dock ännu inte ren – allt bakteriellt mall DNA finns fortfarande kvar. Det bör inte ingå i den slutliga läkemedelsprodukten eftersom det innebär hälsorisker för mottagarna (se avsnitt 4). För att göra sig av med detta DNA tillsätts ett annat enzym som kallas DNas. Detta ska bryta ner DNA:t till mindre fragment, som sedan kan avlägsnas från de mycket större RNA-molekylerna genom filtrering och andra reningstekniker. I det sista steget kombineras mRNA med en lipidblandning för att packas in det i lipidnanopartiklar (LNP), som förmår mänskliga celler att ta upp mRNA-molekylen och producera spikproteinet.
2. Vad kände vi tidigare till om problemet med DNA-kontaminering?
I korthet; väldigt lite. I FDA:s utvärderingsrapporter om båda vaccinen[2,3] nämns inte frågan överhuvudtaget. I Europeiska läkemedelsmyndighetens (EMA) utvärderingsrapport om Pfizer-vaccinet nämns att ”Soliditeten hos DNase:s nerbrytning anses inte vara ordentligt bevisad”[4, s. 17]. Ett liknande språkbruk används i EMA:s rapport om Moderna-vaccinet[5, s. 19f]. Det är dock omöjligt att enbart på grundval av denna knapphändiga information säga om problemet ansågs vara allvarligt och vilka åtgärder som eventuellt krävdes av tillsynsmyndigheten.
3. Oberoende bevis för DNA-kontaminering i mRNA-produkter
Den 3 april 2023 beskrev Kevin McKernan sina senaste forskningsresultat i tre artiklar på sin Subtack-sida[6-8]. De experiment som beskrivs i de två första rapporterna utfördes på ”bivalenta” vaccinprover nyligen lanserade av Pfizer och Moderna. Dessa preparat liknar i sin kemiska sammansättning de tidigare ”monovalenta”, dvs. de ska innehålla mycket rent mRNA, kompletterat med en blandning av lipidmolekyler (fettliknande) i mRNA/lipidnanopartiklar. Den enda skillnaden mellan de två varianterna är att bivalenta vaccin innehåller en blandning av två mRNA som kodar för två antigen varianter av spikproteinet. Detta har ingen betydelse för det tekniska problemet med DNA-kontaminering som sådant. Vi noterar dock att DNA-föroreningar kan variera mellan olika batcher och att endast ett litet antal batcher hittills har karakteriserats i detta avseende.
3.1. McKernans första rapport
I en tidig studie[6] karakteriserade McKernan både RNA och DNA som ingår i mRNA-vacciner.
3.1.1 Extraktion och exakt karakterisering av vaccin nukleinsyror
Första steget var att avlägsna lipiderna för att få fram de rena nukleinsyrorna. Den lösningsmedelsbaserade metod som användes skiljer inte mellan DNA och RNA – om båda finns närvarande kommer båda att samlas upp. De extraherade nukleinsyrorna separerades efter storlek. Detta påvisade inte bara de förväntade kompletta mRNA-sorterna, utan även mindre fragment, vilket tidigare hade noterats både av tillsynsmyndigheter och i publikationer från en av producenterna[9]. Mer överraskande var att också RNA-typer hittades som var större än det kompletta mRNA:t. Dessa varianter är fortfarande okaraktäriserade.
3.1.2 Kvantifiering av extraherade nukleinsyror
I ett förberedande steg för att bestämma de exakta nukleotidsekvenserna hos de extraherade nukleinsyrorna amplifierades de med PCR-metoder. För RNA föregicks PCR av omvänd transkription till DNA med hjälp av ett särskilt enzym (omvänd transkriptas). Eftersom huvudsyftet med studien var att undersöka RNA och inte DNA hämmades DNA genom tillsatt aktinomycin D, som under de givna experimentella förhållandena selektivt undertrycker DNA-syntesen. Därför återfanns relativt små mängder DNA i det amplifierade provet. I Pfizers vaccin överskreds ändå den uppmätta mängden DNA den gräns som EMA godtyckligt fastställt som högsta tillåtna förhållande mellan DNA och RNA.
3.1.3 Resultat av DNA-sekvensering
Kompletta DNA-plasmider erhölls från Pfizer- och Moderna-produkterna, även om vissa frågetecken kvarstod rörande Moderna-plasmider. Plasmidsekvensernas egenskaper kommer därför att diskuteras i samband med McKernans andra studie, som använde mer och mer renat DNA för sekvensering och därför gav mer tillförlitliga resultat.
3.2. McKernans andra rapport
Den andra studien[7] fokuserade på att kvantifiera och karaktärisera den DNA-kontaminering som upptäcktes i den första studien.
3.2.1. Plasmid-DNA i mRNA-vaccin kan föröka sig i bakterieceller
I det första försöket fastställdes om det plasmid-DNA som hittats verkligen är biologiskt funktionellt och kan introduceras och fortleva i bakterieceller. Detta gjordes genom att återigen utvinna nukleinsyror från vaccinproverna. Nukleinsyrorna blandades med E. coli-celler som hade preparerats för DNA-upptag.
Efter att dessa celler absorberat DNA:t och getts tid att återhämta sig spreds de ut i petriskålar fyllda med ett stelnat tillväxtmedium som innehåller kanamycin. Som sagt, kanamycin dödar alla E. coli-celler som inte innehåller en resistensgen mot kanamycin. Tillväxten av bakteriekolonier i petriskålarna bekräftade därför att vissa celler verkligen hade förvärvat resistens mot kanamycin genom att ta upp och sprida plasmiderna. Detta sågs både i proverna från Pfizer- och Modern-vaccin.
Här bör man notera att endast cirkulära, inte linjäriserade, plasmidmolekyler kan införas effektivt i bakterieceller. Framgången i detta experiment tyder därför på att en del av plasmidmolekylerna undkom linjäriseringssteget (steg 4 i avsnitt 1.2) och klarade sig igenom hela processen i den cirkulära form som finns i bakterieceller. Å andra sidan, eftersom antalet bakteriekolonier som observerades i detta experiment inte var stort, är det troligt att det mesta av DNA:t verkligen blev linjäriserat. Eftersom de biologiska riskerna med främmande DNA i våra egna kroppar varierar beroende på om det är linjärt eller cirkulärt, är sannolik förekomst av båda formerna i vaccin anmärkningsvärd. De exakta proportionerna av cirkulärt och linjärt DNA i blandningarna har ännu inte fastställts.
3.2.2 Mängden förorenande DNA
Det andra viktiga resultatet av denna studie är PCR-kvantifieringen av både DNA och mRNA i vaccinprov. I en PCR-reaktion reduceras ett utvalt segment av en nukleinsyresekvens genom enzymatisk syntes under flera på varandra följande reaktionscykler. Utifrån det antal cykler (eller duplikationer) som krävs för att nå en viss tröskelkoncentration kan vi beräkna hur många kopior av målsekvensen som fanns från början.
I experimenten valdes experimentformatet multiplex-PCR, dvs. två målsekvenser amplifierades i en enda reaktionsblandning. En av dessa målsekvenser fanns i spikproteinets gen, och borde därför finnas både i plasmid-DNA-molekylerna och i de spik-mRNA-molekyler som kodats från dem. För att inkludera mRNA-molekylerna i denna kvantifiering föregicks PCR återigen av omvänd transkription.
Den andra målsekvensen fanns i kanamycinresistensgenen, som endast borde finnas i plasmid-DNA. Genom att jämföra antalet cykler som krävs för att var och en av de två målsekvenserna skall nå tröskelvärdet, kunde man fastställa att upp till 35 % av den totala nukleinsyran som finns i vaccinerna faktiskt är DNA. Som jämförelse kan nämnas att EMA har fastställt att DNA inte får utgöra mer än 0,033 % av de totala nukleinsyrorna.
3.2.3 Bestämning av plasmid-DNA-sekvenser
De plasmider som ursprungligen ingick i vaccinen och sedan introducerades i bakterieceller (se avsnitt 3.2.1) isolerades på nytt från dessa bakteriekulturer och deras fullständiga DNA-sekvenser bestämdes. Sådana sekvenser presenterades i sin helhet i McKernans första studie,[6] men han angav att han fortfarande arbetade med att bekräfta och förfina sekvenseringsuppgifterna. Under tiden visas de funktionella egenskaperna hos plasmid-DNA:t som hittades i Pfizer-vaccinproven i figur 1. De kommer att diskuteras i samband med riskbedömningen.
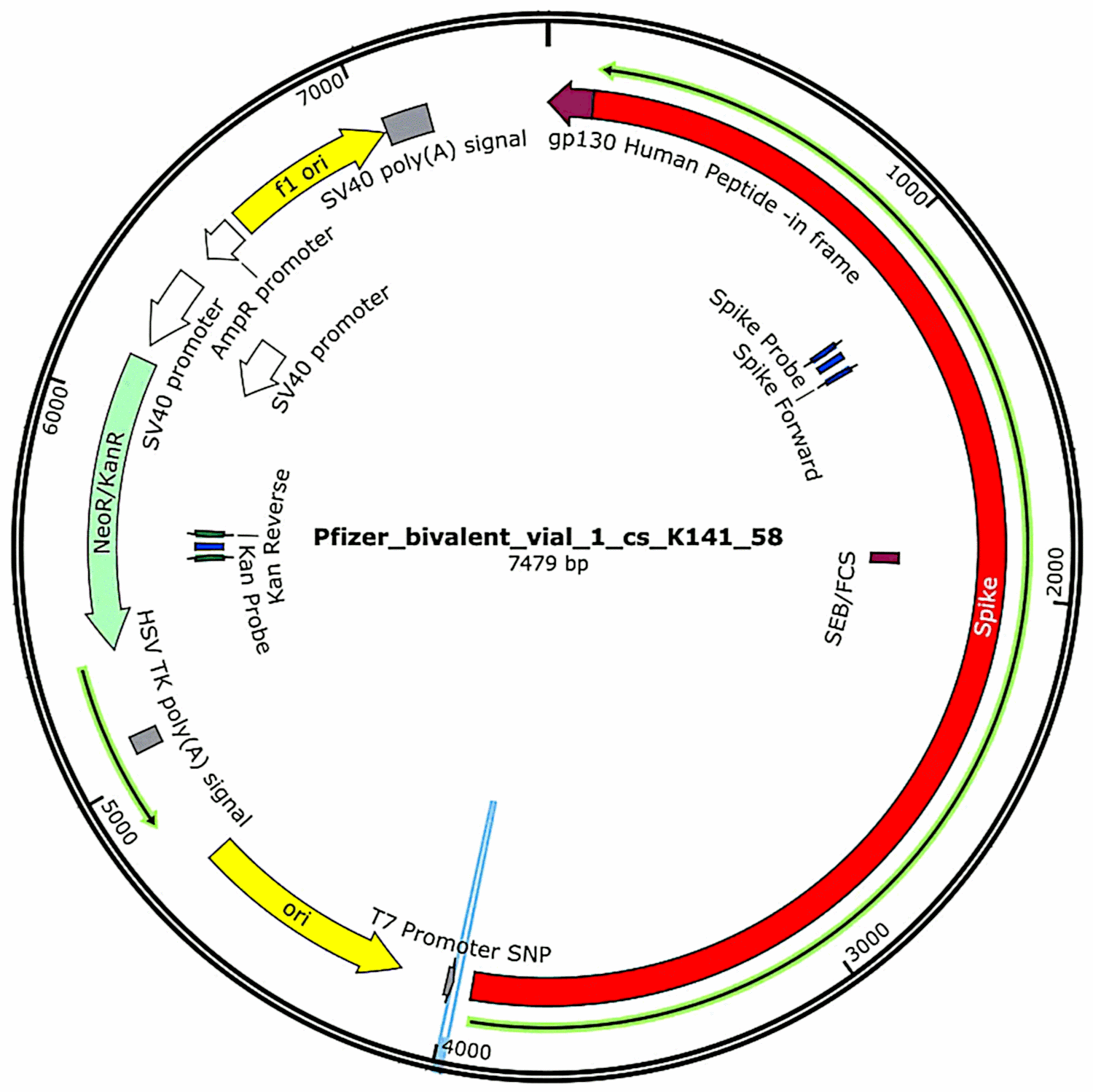
3.3. McKernans tredje rapport
I sin senaste forskningsrapport undersöker McKernan åtta flaskor från en tidigare batch Pfizer-vaccin med hjälp av den kvantitativa PCR-metoden som beskrivs ovan. DNA-innehållet var i detta fall betydligt lägre än i proverna av det bivalenta vaccinet, men överskred ändå gränsen för högsta tillåtna felprocent med en faktor 18-70[8].
4. Riskbedömning
Vi måste anta att det rekombinanta DNA som finns i mRNA-vaccin kan introduceras till kroppens celler och att detta underlättas av lipidnanopartiklar precis som för mRNA. Detta medför flera olika typer av hälsorisker.
4.1. Förlängd spikproteinpåverkan
Ett huvudargument, som regelbundet används för att påstå att mRNA-vaccin är säkra, är att mRNA är kortlivat in vivo och att uttrycket av det kodade antigenet därför också är kortlivat. I EMA:s utvärderingsrapport av Pfizers vaccin står det till exempel, i samband med djurförsök på ett modellvaccin som godtogs i stället för adekvata studier på riktigt COVID-19-vaccin[4, s. 46]:
Som förväntat med en mRNA-produkt var luciferaseexpressionen övergående … Signalen minskade långsamt under de första 72 timmarna och efter 6 och 9 dagar försvagades signalerna ytterligare till nivåer som var ungefär 18- och 7-faldigt högre än de signaler som erhölls från djur som injicerats med buffrad kontrollsubstans.
Dessa resultat verkar stämma överens med två in vitro-studier som jämförde varaktigheten av proteinuttrycket mellan messenger RNA-arter som var identiska i sekvens men innehöll uridin respektive mψU; det senare finns som sagt i mRNA-vacciner från Pfizer och Modern. I båda studierna[1,10] inducerade den mψU-modifierade RNA-arten betydligt högre nivåer av proteinuttryck, men detta höga uttryck minskade dock med en halveringstid motsvarande halveringstiden för omodifierat RNA. Ingen av de halveringstider som kan härledas från data i någon av dessa studier överstiger 4,5 dagar.
Det framgår dock tydligt av flera studier på vaccinerade personer att både själva spikproteinet och de nukleinsyror som kodar för det kan påvisas i blodomloppet och i olika organ i veckor och till och med månader efter injektionen[11-15]. Denna diskrepans mellan in vitro- och in vivo-studier har hittills varit svår att förstå. De höga nivåer av kvarvarande plasmid-DNA i vaccin som McKernan upptäckte skulle kunna vara en rimlig förklaring.
För att bakteriellt plasmid-DNA ska kunna stödja ett långvarigt spikproteinuttryck måste två villkor vara uppfyllda:
- plasmid-DNA:t måste finnas kvar i kroppens celler
- genen för spikprotein i plasmidet måste överföras till mRNA av vårt eget cellulära RNA-polymeras II.
Även om vi ännu inte har någon direkt experimentell data för Pfizers och Modernas spikplasmiders uttryck, tyder prejudicerande fall på att båda kraven faktiskt är uppfyllda. Rekombinanta plasmider som uttrycker koagulationsfaktor IX har visat sig finnas kvar i leverceller hos försöksdjur i stabila nivåer i upp till 1,5 år,[16,17] vilket motsvarade försökets totala längd. Man kan invända att de plasmider som användes i dessa studier var cirkulära, medan det mesta plasmid-DNA som ingår i mRNA-vaccin förmodligen är i linjär form (se avsnitt 1.2). Som svar noterar vi för det första att en del cirkulärt plasmid-DNA troligen finns kvar (se avsnitt 3.2.1), och för det andra att rekombinant viralt DNA har visat sig bestå i linjär form i djur under lika långa perioder[18], vilket tyder på att samma sak kan gälla för plasmid-DNA.
I de nämnda försöksstudierna[16,17] kontrollerades genen som kodar för det aktuella proteinet (faktor IX) med en däggdjurspromotor, och faktorn IX-proteinet uttrycktes verkligen genomgående i stabila nivåer. Däremot står genen för spikproteinet i Pfizers och Modernas uttrycksplasmider under kontroll av en T7-bakteriofagpromotor. Vi kan inte förutsätta att denna promotor kommer att fungera i avsaknad av dess motsvarighet T7 RNA-polymeras. Det har dock bekräftats experimentellt att T7-promotorn faktiskt också binder till cellulärt RNA-polymeras II och ger proteinuttryck i däggdjursceller[19].
Sammanfattningsvis bör riskerna med att uttrycket från spikprotein orsakat av plasmid.DNA i mRNA-vaccin kan påvisas så länge tas på allvar. Den långvariga förekomsten av spikproteinets mRNA och dess uttryck efter vaccination, som upptäckts i biopsier och obduktioner, är tveklöst förknippat med allvarliga skador[14,20], sannolikt från en immunförsvarsreaktion mot de celler som uttrycker detta främmande antigen. Att motsvarande experimentella studier inte genomfördes i den prekliniska testfasen, tillsammans med omfattningen av denna kontaminering, är en fullständigt oacceptabel säkerhetsrisk.
4.2. Risker med reglerande DNA-sekvenser från SV40
Ett inslag som McKernan identifierade i Pfizers plasmider men inte i Modernas[6] är en promotor som härrör från SV40-viruset, som tillhör polyomafamiljen (se avsnitt 4.2). Denna promotor är belägen uppströms kanamycinresistensgenen, och eftersom den är aktiv i däggdjursceller kommer det protein som kodas av denna resistensgen att uttryckas i alla celler som innehåller detta DNA. Liksom spikproteinet är detta protein en främmande antigen, så också det kan utlösa en autoimmun reaktion mot de celler som uttrycker det.
SV40-promotorn innehåller också ett internt replikeringsursprung som potentiellt kan skapa kopior av plasmidet i däggdjursceller[21]. Detta kräver närvaro av den stora virala T-antigenen, ett protein som direkt känner igen detta ursprung och sedan inleder kopiering av DNA-molekylen. Detta protein kodas inte av plasmiden och finns normalt inte heller i våra kroppsceller, utan kommer antingen från själva SV40-viruset eller av ett besläktat polyomavirus. En minoritet av den mänskliga befolkningen är latent infekterad med SV40, och denna latenta infektion är förknippad med vissa maligna och icke-maligna sjukdomar[22]. Om en kopia av Pfizers plasmid introduceras i en cell som hyser SV40 kan ytterligare kopior av den effektivt produceras.
Två besläktade polyomavirus som är mycket mer utbredda i den mänskliga befolkningen är BK- och JC-virus[23,24]. JC:s stora T-antigen verkar vara mindre effektiv i samband med SV40-ursprunget än själva SV40-proteinet[25], men replikation av Pfizer-plasmidet i celler som är latent infekterade med JC- eller BK-virus kan dock inte uteslutas. Ytterligare kopior av plasmiden som genereras på detta sätt skulle öka alla andra risker som diskuteras i detta avsnitt, med möjligt undantag för ospecifik inflammation (se avsnitt 4.4).
4.3. Genomiskt införande av plasmid-DNA
Riskscenarierna som hittills diskuterats baseras alla på en tillfällig oberoende rest av plasmid-DNA; som kommer att finnas i närheten av kromosomerna (inom cellkärnan), men som inte integreras i någon av dem. Sådana oberoende, icke-replikerande plasmidmolekyler tenderar att tappas vid celldelning[26]. Däremot kan en plasmidmolekyl i vissa fall faktiskt integreras i en av kromosomerna i sin värdcell, och kommer då att ärvas av alla den cellens avkommor.
Kromosomintegration är en form av ”genotoxicitet”, dvs. toxicitet som orsakar genetiska skador. När det gäller risker av sådant konstateras det kortfattat i EMA:s utvärderingsrapport om Pfizers mRNA-vaccin[4, s. 50]:
Inga studier om genotoxicitet har lämnats in. Detta är acceptabelt eftersom komponenterna i vaccinets innehållsförteckning är lipider och RNA som inte förväntas ha genotoxisk potential.
Uppenbarligen antog EMA:s experter att RNA i allmänhet inte kommer att påverka värdcellens arvsmassa. Denna uppfattning är felaktig, och det tidigaste beviset för detta firade nyligen femtioårsjubileum[27]. Men eftersom stora mängder plasmid-DNA har upptäckts i vaccin från båda vaccintillverkarna blir det argumentet överflödigt. Även EMA-forskare måste vara medvetna om att detta DNA kan integreras i arvsmassan hos mänskliga värdceller. Det krävs inga särskilda sekvensegenskaper för att en sådan integrering skall ske och man har sett samma sak med DNA från däggdjursvirus, bakteriofager och plasmider[28]. Det är värt att notera att sådana infogningar kan ske på slumpmässiga platser i genomet, men gener som aktivt uttrycks av cellen påverkas oftare[29].
Den stabila kromosomala integrationen av en bakteriell plasmid i kromosomalt DNA i däggdjursceller påvisades redan 1982[30]. Plasmiden i fråga har flera gemensamma egenskaper med de plasmider som används vid tillverkningen av Moderna och Pfizers mRNA-vaccin. Införandet av främmande eller modifierade gener i däggdjursceller med hjälp av denna och liknande tekniker har sedan dess blivit vanligt förekommande inom experimentell forskning och bioteknik. Metoden kallas transfektion och de organismer som modifieras på detta sätt kallas transgener. Vi noterar att stabil integration kan ske med både linjärt och cirkulärt plasmid-DNA[31].
I detta sammanhang bör vi också beakta den tidigare publicerade studien av Aldén et al.[32], som upptäckte DNA-kopior av spikproteingenen i en mänsklig levercellslinje efter att dessa celler exponerats för Pfizers mRNA-vaccin. Utifrån antagandet att vaccinet i huvudsak innehöll rent mRNA men inte DNA, tog de denna observation som bevis för att det syntetiska mRNA:t hade genomgått omvänd transkription i dessa celler. Deras tolkning är rimlig, eftersom sådan omvänd transkription i princip är känd och tidigare har rapporterats i celler från patienter som infekterats med SARS-CoV-2 viruset[33]. Mot bakgrund av McKernans upptäckt att vaccinampuller från Pfizer kan innehålla betydande mängder DNA verkar det dock lika möjligt att Aldén et al:s observationer helt enkelt tyder på att detta DNA tas upp av cellerna. I vilket fall som helst tyder dock deras resultat på att det finns spikkodande DNA i dessa celler, vilket påvisar en risk för genomisk insättning.
4.3.1 Genomisk insättning vid genterapi med retrovirala vektorer
Vid riktig genterapi är kromosomal integration ofta önskvärd, eftersom den korrigerar den genetiska defekten i fråga på ett varaktigt sätt. För detta ändamål har man utvecklat särskilda DNA-vektorer som har en mycket större benägenhet att genomgå en sådan integration. Dessa vektorer härstammar från retrovirus, vars hela överlevnadsstrategi bygger på genomisk integration. Det visar sig dock att integration, när den sker på fel plats i genomet, ofta framkallar maligna sjukdomar, särskilt leukemi[34]. Detta är faktiskt så vanligt att det har förhindrat ett allmänt införande av genterapi, även för sjukdomar för vilka alla andra terapeutiska alternativ är lika behäftade med mycket allvarliga risker. Ett bra exempel är adenosindeaminasbrist, en metabolisk sjukdom som eliminerar lymfocyter och därmed orsakar svår kombinerad immunbrist (SCID), ett tillstånd som utan behandling alltid är dödligt under barndomen. Denna sjukdom är mycket lämplig för genterapi, men en benmärgstransplantation från en matchad och besläktad donator förblir ändå det terapialternativ som föredras på grund av den allvarliga risken för genterapiinducerad malignitet[35].
4.3.2 Hur orsakar genomisk insättning maligniteter?
Vårt genom innehåller flera gener som kan ge upphov till cancer om deras uttrycksnivå – den hastighet med vilken mRNA och proteinmolekyler syntetiseras från dem – är för låg eller för hög. En främmande DNA-molekyl kan råka infogas direkt i en sådan gen och slå ut den helt, eller så kan den infogas bredvid den, och en stark promotor som finns i det främmande DNA:t kan orsaka överexpression av genen i fråga. Dessutom har det observerats att introduktioner också kan orsaka förändringar i DNA-metylering i hela genomet, vilket påverkar uttrycksnivåerna för många gener, och vissa av dessa förändringar kan bidra till att framkalla malignitet. Det är viktigt att notera att denna effekt har observerats inte bara i viralt DNA utan även i bakteriella plasmider[36].
När celler isoleras från ett friskt organ från människa eller djur och odlas i cellkultur delar de sig under ett begränsat antal generationer och dör sedan. Däremot kan celler som härrör från maligna tumörer och leukemier förökas i all oändlighet. En liknande förändring kan också ske i odlade celler, som därmed blir odödliga och vanligtvis också förlorar vissa egenskaper som är karakteristiska för deras ursprungsvävnad. Denna omvandling kan till exempel framkallas genom att infektera cellerna med det tidigare nämnda SV40-viruset. På samma sätt kan cellerna omvandlas genom transfektion med en plasmid som härrör från SV40 och som innehåller de viktigaste delarna av virusgenomet, inklusive den gen som kodar för det stora T-antigenet. Om det stora T-antigenet däremot saknas i plasmidet sker vanligtvis ingen transformation[30]. Vissa undantag har dock rapporterats[37,38]. Dessa fall måste ha uppstått på grund av störning eller nedreglering av cellulära gener som är involverade i proliferationskontrollen.
4.3.3 Genomisk integration i könsceller
Oocyter kan transfekteras in vivo vid vissa mognadsstadier[39], liksom spermieproducerande celler i testiklarna[40]. I det senare fallet har det visat sig att avkomman från djur som utsatts för sådan behandling är transgena, genmodifierade. Det kan därför inte uteslutas att personer som injiceras med mRNA-vacciner som också innehåller DNA senare kommer att ge upphov till transgena barn. Införandet av DNA i könsceller kan också störa den tidiga intrauterina utvecklingen och därmed leda till spontana aborter eller missbildningar.
4.3.4 Hur ska risken för genomisk insättning bedömas?
Det är visserligen sant att bakteriella plasmider har en lägre benägenhet att infogas i vårt kromosomala DNA än genterapivektorer som är särskilt utformade för effektiv integration. Men exakt hur stor är risken när det gäller plasmider som ingår i mRNA-vaccin? Det enkla svaret är att ingen vet. Detta beror inte på att risken är principiellt okänd, utan på att lämpliga experimentella studier på djur och senare på människor inte har gjorts, eller om de har gjorts har resultaten undanhållits allmänheten och tydligen även tillsynsmyndigheterna.
Hur skulle sådana risker bedömas vid en korrekt genomförd godkännandeprocess? I de nuvarande riktlinjerna från FDA om testning och godkännande av genterapier[41] rekommenderas att patienterna under den kliniska testfasen övervakas i 15 hela år efter administration, med årliga undersökningar under de första fem åren. Detta gäller de vektorer som det kromosomala införandet är avsett för. I vägledningsdokumentet konstrueras en falsk dikotomi mellan inskjutningsvektorer och icke-inskjutningsvektorer, men skiljelinjen mellan dem förblir otydlig. Å ena sidan föreslår vägledningen att
GT [genterapiprodukter] som baseras på vektorer som plasmider … är inte benägna att integreras eller reaktiveras efter en latent period och har i allmänhet en lägre risk för fördröjda biverkningar,
men å andra sidan anges att
förändringar i de metoder som används för att föra in plasmid-DNA-vektorer i celler … resulterar i högre integrationsfrekvenser (Ref. 27).
Det sista citatet är från en studie av Wang et al.[42], som entydigt identifierade plasmid-DNA-insättning in vivo efter intramuskulär injektion, som följdes av elektroporering. Även om elektroporering ökade det cellulära upptaget av injicerat DNA i förhållande till injektion av enbart ”naket” DNA, var det troligen mycket mindre effektivt i detta avseende än de lipidnanopartiklar som ingår i mRNA-vacciner. Följaktligen bör vi förvänta oss en viss kromosomal integration av det kontaminerande plasmid-DNA:t in vivo.
4.4. Proinflammatorisk effekt av bakteriellt DNA
Människans medfödda immunförsvar reagerar med inflammation på olika bakteriella makromolekyler, inklusive DNA. De stora mängder DNA som finns i vaccin bör anses bidra till inflammation i närheten av injektionsstället och eventuellt även på andra ställen i kroppen.
5. Slutsats
Förekomsten av kontaminerande plasmid-DNA i Pfizers och Modernas mRNA-vaccin medför allvarliga hälsorisker, utöver dem som redan är kända och klarlagda. Dessa risker omfattar långvarigt uttryck av spikproteinet, vilket kan orsaka, och ge en mer destruktiv, autoimmun inflammation, och trigga maligna sjukdomar efter kromosomal integration av plasmid-DNA. Dessutom bevisar omfattningen av kontamineringen att tillverkarna inte behärskar eller tillämpar de produktionsprocesserna på ett korrekt sätt. Vart och ett av detta är i sig tillräckligt skäl för att kräva ett omedelbart återkallande av dessa vaccin.
Tack
Vi tackar Kevin McKernan och Ulrike Kämmerer för korrigeringar och diskussioner.
Upphovsrätt
Denna text är licensierad enligt villkoren i Creative Commons Attribution 4.0 International License (CC BY 4.0). Detta innebär att det är fritt att kopiera och återanvända innehållet, förutsatt att de ursprungliga författarna anges. Om du gör ändringar i texten måste du uttryckligen ange detta. Mer information finns på webbplatsen Creative Commons[43].
Referenser
- Andries, O. et al. (2015) N1-metylpseudouridin-inkorporerat mRNA överträffar pseudouridin-{}-inkorporerat mRNA, ger förbättrat proteinuttryck och minskar immunogeniciteten i däggdjurs- och muscellinjer. J. Control.Release 217:337-344
- Anonymt, (2020) FDA briefing document: Pfizer-BioNTech COVID-19 vaccin.
- Anonym, (2020) FDA briefing document : modern MRNA-1273.
- Anonym, (2021) EMA:s bedömningsrapport: Comirnaty.
- Anonym, (2021) EMA:s bedömningsrapport: COVID-19 Moderna Vaccine.
- McKernan, K. (2023) Deep sequencing of Moderna and Pfizer bivalent vaccines identifies contamination of expression vectors designed for plasmid amplification in bacteria.
- McKernan, K. (2023) Pfizer och Moderna bivalenta vacciner innehåller 20-35 % expressionsvektorer och är kompetenta att transformera E.coli.
- McKernan, K. (2023) DNA-kontaminering i 8 flaskor med monovalenta mRNA-vacciner från Pfizer.
- Patel, H.K. et al. (2023) Karaktärisering av BNT162b2 mRNA för att utvärdera risken för off target-antigentranslation. J. Pharm.Sci. DOI:10.1016/j.xphs.2023.01.007
- Pardi, N. et al. (2018) Nukleosidmodifierade mRNA-vacciner inducerar potenta T-follikulära hjälparbetare och germinala center B-cellsvar. J. Exp. Med. 215:1571-1588
- Bansal, S. et al. (2021) Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies: En ny mekanism för immunaktivering av mRNA-vacciner. J. Immunol. 207:2405-2410
- Castruita, J.A.S. et al. (2023) SARS-CoV-2 spike RNA-vaccinsekvenser cirkulerar i blodet upp till 28 dagar efter COVID-19-vaccination. APMIS 131:128-132
- Fertig, T.E. et al. (2022) Vaccinets mRNA kan påvisas i blodet 15 dagar efter vaccination. Biomedicines 10:1538
- Magen, E. et al. (2022) Klinisk och molekylär karakterisering av ett sällsynt fall av BNT162b2 mRNA COVID-19 Vaccine-Associated Myositis. Vaccines 10
- Röltgen, K. et al. (2022) Immune imprinting, amplitud av variantigenkänning och germinal centersvar vid mänsklig SARS-CoV-2-infektion och vaccination. Cell DOI:10.1016/j.cell.2022.01.018
- Miao, C.H. et al. (2001) Långsiktigt och terapeutiskt hepatiskt genuttryck av human faktor IX efter naken plasmidöverföring in vivo. Mol. Ther. 3:947-57
- Ye, X. et al. (2003) Fullständig och hållbar fenotypisk korrigering av hemofili B hos möss efter hepatisk genöverföring av en plasmid med högt uttryck av human faktor IX. J. Thromb. Haemost. 1:103-11
- Jager, L. och Ehrhardt, A. (2009) Persistens av adenovirala vektorer med hög kapacitet som monomera replikationsdefekta genomer in vitro och i murinlever. Hum.Gene Ther. 20:883-96
- Li, Y.Q. et al. (2000) [T7-promotorns funktion som cis-verkande element för polymeras II i eukaryota celler]. Yi Chuan Xue Bao 27:455-61
- Mörz, M. (2022) En fallrapport: Nekrotiserande encefalit och multifokal myokardit efter BNT162b2 mRNA-vaccination mot Covid-19. Vaccines 10:2022060308
- Byrne, B.J. et al. (1983) Definition av den tidiga promotorregionen för simian virus 40 och påvisande av en värdområdeförskjutning i förstärkningseffekten av den upprepade upprepningen av 72 baspar i simian virus 40. Proc.Natl.Acad.Sci.U. S. A. 80:721-5
- Rotondo, J.C. et al. (2019) Samband mellan simiskt virus 40 och mänskliga tumörer. Front.Oncol. 9:670
- DeCaprio, J.A. and Garcea, R.L. (2013) A cornucopia of human polyomavirus. Nat.Rev. Microbiol. 11:264-76
- Hussain, I. et al. (2020) Human BK and JC polyomavirus: molecular insights and prevalence in Asia. Virus Res. 278:197860
- La Bella, F. och Ozer, H.L. (1985) Differentiell replikation av SV40- och polyoma-DNA i ovarieceller från kinesisk hamster. Virus Res. 2:329-44
- Ehrhardt, A. et al. (2003) Episomal persistens av rekombinanta adenovirala vektorgenom under cellcykeln in vivo. J. Virol. 77:7689-95
- Baltimore, D. (1970) RNA-beroende DNA-polymeras i virioner av RNA-tumörvirus. Nature 226:1209-11
- Doerfler, W. (2016) Beware of genome manipulations: epigenetic destabilization via (foreign) DNA insertions. Epigenomics 8:587-91
- Doerfler, W. (1996) A new concept in (adenoviral) oncogenesis: foreign DNA integration and its consequences. Biochim.Biophys.Acta 1288:F79-99
- Southern, P.J. och Berg, P. (1982) Transformation av däggdjursceller till antibiotikaresistens med en bakteriegen under kontroll av SV40-promotorn i den tidiga regionen. J. Mol. Appl. Genet. 1:327-41
- Stuchbury, G. och Münch, G. (2010) Optimering av genereringen av stabila neuronala cellinjer genom restriktiva enzymer för digestion av plasmid-DNA före transfektion. Cytotechnology 62:189-94
- Aldén, M. et al. (2022) Intracellulär omvänd transkription av Pfizer BioNTech COVID-19 mRNA-vaccin BNT162b2 in vitro i en mänsklig levercelllinje. Curr.Emite Mol.Biol. 44:1115-1126
- Zhang, L. et al. (2020) SARS-CoV-2 RNA transkriberat och integrerat i det mänskliga genomet. bioRxiv DOI:10.1101/2020.12.12.12.422516
- Staal, F.J.T. et al. (2008) Sola dos facit venenum. Leukemi i genterapiprovningar: en fråga om vektorer, instick och dosering? Leukemia 22:1849-1852
- Kohn, D.B. och Gaspar, H.B. (2017) Hur vi hanterar Adenosine Deaminase-Deficient Severe Combined Immune Deficiency (ADA SCID). J. Clin. Immunol. -n/a
- Doerfler, W. et al. (2018) Ärftligt epigenetiskt svar mot främmande DNA-inträde i värdceller från däggdjur: en väktare av genomisk stabilitet. Epigenetics 13:1141-1153
- Sipehia, R. och Martucci, G. (1995) Högeffektiv transformation av mänskliga endotelceller genom Apo E-medierad transfektion med plasmid-DNA. Biochem.Biophys.Commun.Res. 214:206-11
- Takahashi, M. et al. (2002) Transformation av MC3T3-E1-celler efter stress och transfektion med plasmid pSV2neo. Anticancer Res. 22:585-98
- Laurema, A. et al. (2003) Transfektion av oocyter och andra typer av äggstocksceller hos kaniner efter direkt injektion i livmoderartärer av adenovirus och plasmid/liposomer. Gene Ther. 10:580-4
- Dhup, S. och Majumdar, S.S. (2008) Transgenes genom permanent genintegration vid repopulation av spermatogoniala celler in vivo. Nat.Methods 5:601-3
- Anonym, (2020) Långtidsuppföljning efter administrering av humana genterapiprodukter: Vägledning för industrin.
- Wang, Z. et al. (2004) Detektion av integration av plasmid-DNA i värdgenomiskt DNA efter intramuskulär injektion och elektroporation. Genterapi. 11:711-21
- Anonym, (2023) Creative Commons Attribution 4.0 International License (CC BY 4.0).
Ursprungligen publicerad i Doctors for Covid Ethics
Suggest a correction







