COVID-19 мРНК ваксините съдържат прекомерно количество бактериална ДНК: доказателства и последствия
Неотдавнашни проучвания на Кевин МакКернан, водещ експерт в областта на методите за секвениране на ДНК и РНК, разкриха, че партидите от модифицирани мРНК ваксини, произведени от Pfizer и Moderna, съдържат голям дял замърсяваща бактериална ДНК. Като цяло ДНК представлява до 20-35 % от нуклеиновите киселини, съдържащи се във всяка от партидите ваксини. Тези тревожно високи концентрации далеч надхвърлят нивата, считани за безопасни от стандартизиращи организации като Европейската агенция по лекарствата (ЕМА). В този документ се обобщават доказателствата за това замърсяване с ДНК и се обсъждат възможните рискове за здравето на получателите на ваксини.
1. Ролята на ДНК при производството на мРНК ваксини
1.1. Общ контекст
Повечето читатели са наясно, че
- синтетичните РНК, съдържащи се в мРНК ваксините COVID-19, кодират шиповият белтък SARS-CoV-2;
- в живите клетки на бозайниците инструкциите за изграждане на дадена белтъчна молекула се съхраняват като ген в ДНК в ядрото;
- за да изгради дадена белтъчна молекула, клетката първо транскрибира гена в РНК и модифицира двата края на тази молекула, за да образува информационна РНК (мРНК). След това мРНК се пренася от ядрото в цитоплазмата, където подтиква фабриките за белтъци на клетката – рибозомите – да преведат нуклеотидната последователност на мРНК в съответната аминокиселинна последователност и да сглобят белтъка.
1.2. етапи в производството на мРНК ваксини
Тъй като шиповият белтък е голяма молекула, такава е и мРНК, която го кодира. Пълният химичен синтез на големи молекули мРНК не е практичен в голям мащаб. Ето защо, за да се получи молекулата на кодиращата мРНК на пика, процесът, при който клетките произвеждат собствените си мРНК, се имитира in vitro. Това включва следните стъпки:
- В бактериален плазмид се вмъква ДНК копие на гена за шиповия протеин. Това е двойноверижна ДНК молекула с пръстеновидна форма, която може да съществува в бактериална клетка независимо от собствената хромозомна ДНК на клетката и която също може да се копира и предава на двете дъщерни клетки, когато тази клетка се дели.
- Рекомбинантният (изкуствен) плазмид, носещ гена на шиповия протеин, се въвежда в клетка от бактериалния вид Escherichia coli (E. coli ). Тъй като клетките на E. coli се делят много бързо, тази единична клетка може за кратко време да се разрасне до много голям брой клетки. Всяка от тези прогениторни клетки ще съдържа свои собствени наследствени копия на плазмида и по този начин гена на шиповия протеин. Въпреки че има известна вероятност плазмидът да бъде изгубен от някои от потомците по време на последователните клетъчни деления, можем да наложим неговото поддържане, като му дадем селективен маркер, който гарантира, че ще оцелеят само клетките, които запазват плазмида. При плазмидите, използвани от Pfizer и Moderna, този селективен маркер е ген, който дава на клетките-гостоприемници устойчивост към антибиотика канамицин. За да се приложи селекция, бактериите просто се отглеждат в присъствието на канамицин.
- След отглеждането на достатъчен брой бактериални клетки в хранителен бульон, съдържащ канамицин, тези клетки се разграждат и плазмидната ДНК се пречиства от другите компоненти на бактериалните клетки.
- Пръстеновидните плазмидни молекули се превръщат в линейна форма с помощта на рестрикционен ензим, който разцепва двете нишки на ДНК молекулата на специфично, уникално място след гена на шиповия протеин. Тази стъпка е необходима, за да се предотврати образуването на РНК молекули, които са твърде дълги и могат да имат нежелани ефекти in vivo. Линеаризираните ДНК молекули могат да бъдат пречистени от останалите кръгови молекули, но не е публично известно как и колко ефективно може да се направи това при производството на ваксините на Pfizer и Modern.
- Използва се РНК полимераза, в присъствието на необходимите нуклеозидни градивни елементи и кофактори, за да се копира генът на шиповия протеин от ДНК версията върху линеаризирания плазмид до мРНК версията. Както Pfizer, така и Moderna използват РНК-полимераза Т7, която произлиза от едноименния бактериофаг. Този ензим се свързва със сродна промоторна последователност, също получена от Т7, която е вградена в плазмида преди гена за шиповия протеин. Това взаимодействие между полимеразата и промотора инициира транскрипцията. На този етап синтетичният нуклеозид N-метил-псевдоуридин (mψU) се включва в изкуствената РНК вместо естествения нуклеозид уридин. Когато се прилага под формата на ваксина, модифицираната по този начин РНК е по-малко стимулираща за вродената имунна система, отколкото РНК, съдържаща естествения уридин. Тя също така се превръща по-ефективно в протеин и при определени условия е по-устойчива на разграждане[1]. МРНК ваксините на Pfizer и Moderna съдържат mψU вместо уридин.
- Двата края на всяка РНК молекула са ензимно свързани с определени молекули, които се намират на тези позиции и в естествените мРНК на бозайниците и които повишават биологичната им активност и стабилност in vivo.
Тези стъпки осигуряват функционална мРНК, способна да инструктира рибозомите на клетките да произвеждат шиповия протеин. На този етап обаче продуктът все още не е чист – все още е налице цялата шаблонна ДНК, получена от бактериите. Последната не трябва да се включва в крайния лекарствен продукт, тъй като представлява риск за здравето на получателите (вж. раздел 4). За да се отстрани тази ДНК, се добавя друг ензим, наречен ДНейз. Това трябва да разгради ДНК на по-малки фрагменти, които след това могат да бъдат отстранени от много по-големите молекули РНК чрез филтриране и други техники за пречистване. На последния етап мРНК се комбинира със смес от липиди, за да се опакова в липидни наночастици (LNP), които подтикват човешките клетки да приемат молекулата на мРНК и да произведат шиповия протеин.
2. Какво знаехме досега за проблема със замърсяването с ДНК?
Накратко, много малко. В докладите на Федералната Агенция по Лекарства на САЩ (FDA) за оценка на двете ваксини[2,3] този проблем изобщо не се споменава. В доклада за оценка на Европейската агенция по лекарствата (ЕМА) за ваксината на Pfizer се споменава, че „стабилността на етапа на разграждане с ДНейз не се счита за напълно доказана“ [4, стр. 17]. Подобна формулировка е използвана и в доклада на ЕМА за ваксината Moderna [5, стр. 19е]. Въпреки това, само въз основа на тази оскъдна информация, не е възможно да се каже дали проблемът е бил считан за сериозен и какви мерки са били изисквани от регулатора, ако е имало такива.
3. Независими доказателства за ДНК замърсяване на мРНК продукти
Към 3 април 2023 г. Кевин МакКернан описва последните си открития в три статии на своя уебсайт в платформата Subtack [6-8]. Експериментите, описани в първите два доклада, са извършени върху проби от „бивалентни“ ваксини, въведени наскоро от Pfizer и Moderna. Тези препарати приличат на предишните „моновалентни“ по своя химичен състав, т.е. те трябва да съдържат високопречистена мРНК, комплексирана със смес от липидни (подобни на мазнини) молекули в мРНК/липидни наночастици. Единствената разлика между двете разновидности е, че двувалентните ваксини съдържат смес от две мРНК, кодиращи два антигенни варианта на шиповия протеин. Това няма никакво отношение към техническия проблем на ДНК замърсяването като такова. Все пак отбелязваме, че степента на ДНК замърсяване може да варира между производствените партиди и че досега само малък брой партиди са били характеризирани в това отношение.
3.1. Първи доклад на МакКернан
В едно ранно проучване[6] МакКернан характеризира както РНК, така и ДНК, съдържащи се във ваксините с мРНК.
3.1.1 Екстракция и директно охарактеризиране на нуклеиновите киселини на ваксините
Първата стъпка беше да се отстранят липидите, за да се получат чисти нуклеинови киселини. Използваният метод на базата на разтворител не прави разлика между ДНК и РНК – ако присъстват и двете, ще бъдат извлечени и двете. Екстрахираните нуклеинови киселини бяха разделени според размера. Това разкри не само очакваните редовни, пълноценни видове мРНК, но и по-малки фрагменти, които преди това бяха отбелязани както от регулаторите, така и в публикувана работа на един от производителите[9]. Още по-изненадващо е, че бяха открити и РНК видове, по-големи от мРНК с пълна дължина. Тези видове остават нехарактеризирани.
3.1.2 Амплификация на извлечените нуклеинови киселини
Като подготвителна стъпка за определяне на точните нуклеотидни последователности на извлечените нуклеинови киселини, те бяха амплифицирани чрез PCR методи. В случая на РНК, PCR беше предшестван от обратна транскрипция в ДНК с помощта на специален ензим (обратна транскриптаза). Тъй като основната цел на това изследване е да се изследва РНК, а не ДНК, тази стъпка на амплификация е насочена срещу ДНК чрез добавяне на актиномицин D, който при дадените експериментални условия селективно инхибира синтеза на ДНК. По този начин в амплифицираната проба бяха възстановени сравнително малки количества ДНК. В случая с ваксината на Pfizer обаче количеството ДНК, което е установено, че присъства, вече е надхвърлило произволно определената от ЕМА граница за максимално допустимото съотношение между ДНК и РНК.
3.1.3 Резултати от секвенирането на ДНК
При продуктите на Pfizer и Moderna бяха получени ДНК секвенции на пълни ДНК плазмиди, въпреки че в случая с плазмидите на Moderna останаха някои неясноти. Поради това характеристиките на плазмидните секвенции ще бъдат разгледани във връзка с второто изследване на МакКернан, при което за секвенирането е използвана все по-чиста ДНК и следователно са получени по-надеждни резултати.
3.2. Втори доклад на МакКернан
Второто проучване[7] се фокусира върху количественото определяне и характеризиране на ДНК замърсяването, което беше качествено установено в първото.
3.2.1. плазмидната ДНК, съдържаща се в мРНК ваксините, е компетентна да се размножава в бактериални клетки
В първия експеримент беше установено дали плазмидната ДНК, чието наличие беше предположено от предишните резултати за секвенцията, е наистина биологично функционална, в смисъл че може да бъде въведена и да се запази в бактериални клетки. За тази цел отново бяха извлечени нуклеинови киселини от пробите на ваксината. Тези нуклеинови киселини бяха смесени със суспензия от клетки на E. coli, които бяха направени компетентни за поемане на ДНК.
След като тези клетки бяха подтикнати да приемат ДНК и им бе дадено известно време да се възстановят, те бяха разпределени в Петри стъкла, пълни със затвърдена среда за растеж, съдържаща канамицин. Както беше отбелязано по-рано, канамицинът ще убие всяка клетка на E. coli, която не съдържа ген за резистентност към него. Следователно наблюдаваният растеж на бактериални колонии в тези стъкла на Петри потвърди, че някои клетки наистина са придобили резистентност към канамицин, като са приели и разпространили плазмидите. Това беше наблюдавано както при пробите на ваксината Pfizer, така и при пробите на ваксината Modern.
В този контекст трябва да отбележим, че само кръговите, но не и линеаризираните плазмидни молекули могат да бъдат ефикасно въведени в бактериалните клетки. Следователно успехът на този експеримент предполага, че някои от плазмидните молекули са избегнали етапа на линеаризация (етап 4 в раздел 1.2) и са преминали през целия производствен процес в кръговата форма, която съществува в бактериалните клетки. От друга страна, тъй като броят на наблюдаваните в този експеримент бактериални колонии не е голям, вероятно по-голямата част от ДНК наистина е била линеаризирана. Тъй като биологичната опасност от чуждата ДНК в собственото ни тяло може да варира в зависимост от това дали тя е линейна или кръгова, вероятното наличие и на двете форми във ваксините заслужава внимание. Точното съотношение на кръговата и линейната ДНК в смесите предстои да бъде определено.
3.2.2 Изобилие на замърсяваща ДНК
Второто важно откритие на това проучване е количественото определяне чрез PCR на ДНК и мРНК, съдържащи се в пробите от ваксини. Както може би знаете, при PCR реакцията избран сегмент от последователността на нуклеиновата киселина се редуцира чрез ензимен синтез в продължение на няколко последователни цикъла на реакцията. От броя на циклите (или дублиранията), необходими за достигане на определена прагова концентрация, можем да изчислим колко копия на целевата последователност са присъствали в началото.
В тези експерименти избраният експериментален формат е мултиплексен PCR, т.е. две целеви последователности са амплифицирани в една реакционна смес. Едната от тези целеви секвенции е в гена на белтъка на шипа и следователно трябва да присъства както в молекулите на плазмидната ДНК, така и в молекулите на шиповото мРНК, транскрибирани от тях. За да се включат молекулите на мРНК в това амплифициране, PCR отново беше предшестван от обратна транскрипция.
Другата целева последователност беше в гена за канамицинова резистентност, който трябва да присъства само в плазмидната ДНК. Чрез сравняване на броя на циклите, необходими за преминаване на прага на всяка от двете цели, беше установено, че до 35 % от общата нуклеинова киселина, съдържаща се във ваксините, всъщност е ДНК. За сравнение ЕМА е определила, че ДНК не трябва да бъде повече от 0,033 % от общите нуклеинови киселини.
3.2.3 Определяне на плазмидните ДНК последователности
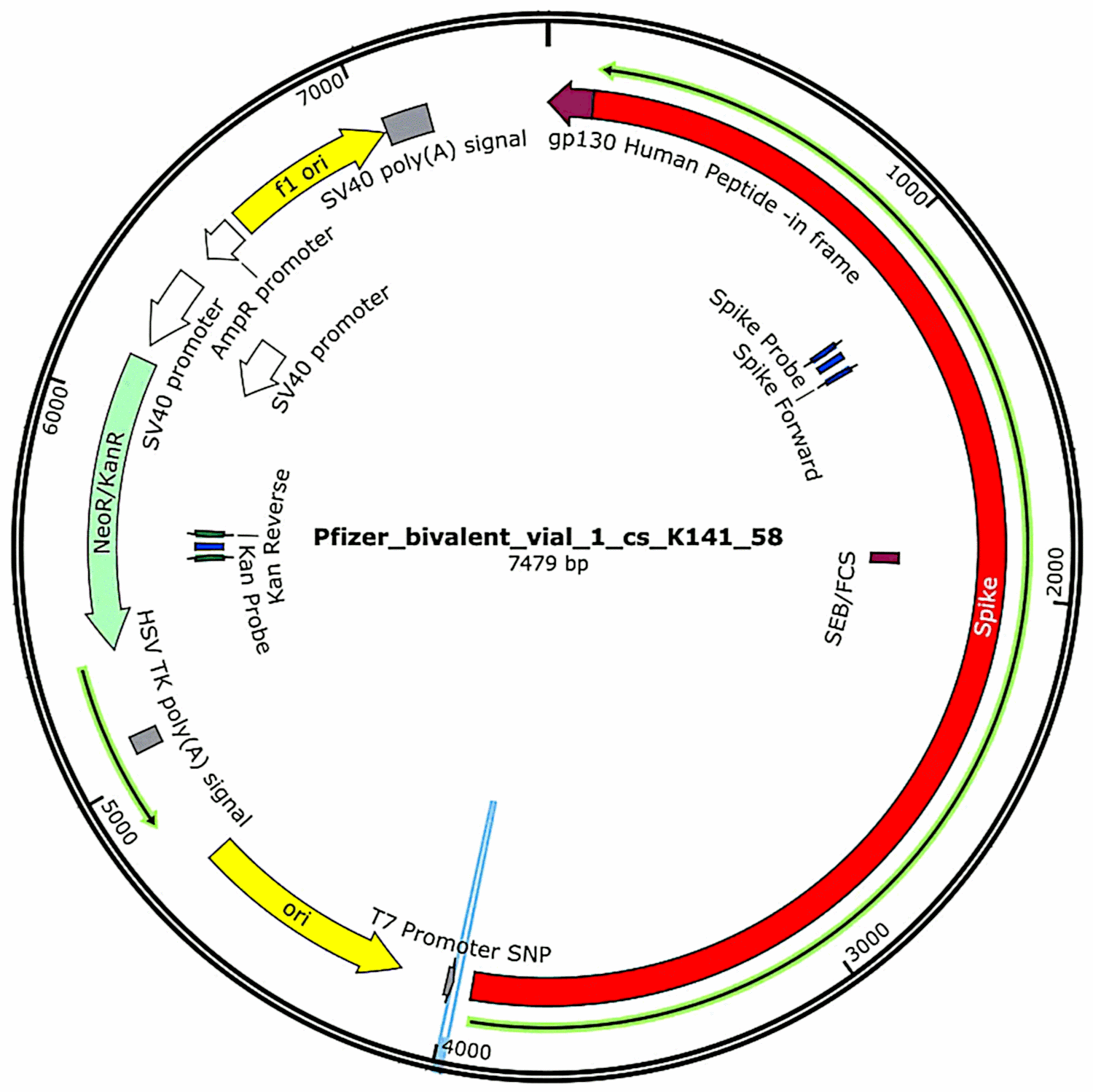
Плазмидите, които първоначално са се съдържали във ваксините и след това са били въведени в бактериални клетки (вж. раздел 3.2.1), отново са били изолирани от тези бактериални култури и са били определени пълните им ДНК последователности. Такива последователности бяха предоставени изцяло в първото проучване на МакКернан, [6] но той посочи, че все още работи по потвърждаване и уточняване на данните за секвенирането. Междувременно функционалните характеристики на плазмидната ДНК, открита в пробите от ваксината на Pfizer, са показани на фигура 1. Те ще бъдат разгледани във връзка с оценката на риска.
3.3. Трети доклад на МакКернан
В последния си доклад до момента МакКернан изследва осем флакона от по-ранна партида ваксина на Pfizer, като използва описания по-горе количествен PCR метод. Съдържанието на ДНК в този случай е било значително по-ниско, отколкото в пробите от бивалентната ваксина, но все пак е превишавало границата на МРЕ 18-70 пъти[8].
4. Оценка на риска
Трябва да приемем, че рекомбинантната ДНК, съдържаща се в мРНК ваксините, може да бъде въведена в клетките на нашето тяло и че това ще бъде подпомогнато от липидни наночастици, точно както при самата мРНК. Това създава няколко различни вида рискове за здравето.
4.1. удължаване на продължителността на експресията на шиповия протеин
Ключов аргумент, който редовно се използва за насърчаване на възприеманата безопасност на мРНК ваксината, е, че мРНК е с кратък живот in vivo и че следователно експресията на кодирания антиген също ще бъде с кратък живот. Например в доклада на EMA за оценка на ваксината на Pfizer се посочва във връзка с експерименти с животни върху моделна ваксина, които са били приети вместо адекватни изследвания върху самата ваксина COVID-19 [4, стр. 46]:
Както се очаква при мРНК продукт, експресията на луцифераза е преходна … Сигналът бавно намаляваше през първите 72 часа, а след 6 и 9 дни сигналите бяха допълнително отслабени до нива, приблизително 18- и 7 пъти по-високи от сигналите, получени от животни, инжектирани с буферирана контрола.
Тези резултати изглежда съвпадат с две in vitro проучвания, които сравняват продължителността на протеиновата експресия между видове информационна РНК, които са идентични по последователност, но съдържат съответно уридин или mψU; както беше отбелязано по-рано, последният също присъства в mRNA ваксините на Pfizer и Moderna. И в двете проучвания [1,10] модифицираните с mψU видове РНК предизвикват значително по-високи нива на протеинова експресия, но тази висока експресия намалява с период на полуразпад, подобен на този на немодифицираната РНК. Нито един от периодите на полуразпад, които могат да бъдат изведени от данните в двете изследвания, не надвишава 4,5 дни.
От многобройните проучвания върху ваксинирани лица обаче става ясно, че както самият шипов протеин, така и кодиращите го нуклеинови киселини могат да бъдат открити в кръвния поток и в различни органи в продължение на седмици и дори месеци след инжектирането[11-15]. Това несъответствие между изследванията in vitro и in vivo досега беше трудно за разбиране. Сега високите нива на остатъчна плазмидна ДНК във ваксините, открити от МакКернан, предполагат правдоподобно обяснение.
За да може бактериалната плазмидна ДНК да поддържа продължителна експресия на белтъка шип, трябва да са изпълнени две условия:
- плазмидната ДНК трябва да се задържи в клетките на нашето тяло, и
- генът на шиповия протеин в този плазмид трябва да се транскрибира в мРНК от нашата собствена клетъчна РНК полимераза II.
Въпреки че, все още не разполагаме с преки експериментални данни за плазмидите за шиповата експресия на Pfizer и Moderna, прецедентът предполага, че всъщност и двете изисквания са изпълнени. Установено е, че рекомбинантните плазмиди, експресиращи фактор на кръвосъсирването IX, се задържат в чернодробните клетки на опитни животни на стабилни нива до 1,5 години [16,17], което съответства на общата продължителност на експеримента. Може да се възрази, че използваните в тези изследвания плазмиди са били кръгови, докато повечето плазмидни ДНК, съдържащи се във ваксините срещу мРНК, вероятно са в линейна форма (вж. раздел 1.2). В отговор на това отбелязваме, че, първо, част от кръговата плазмидна ДНК вероятно остава (вж. раздел 3.2.1) и, второ, че е доказано, че рекомбинантната вирусна ДНК се запазва в линейна форма в животни за подобни дълги периоди от време [18], което предполага, че същото може да се отнася и за плазмидната ДНК.
В цитираните изследвания [16,17] генът, кодиращ интересуващия ни протеин (фактор IX), е бил под контрола на промотор от бозайник и наистина протеинът на фактор IX е бил експресиран на стабилни нива през цялото време. За разлика от това, генът на шиповия протеин, съдържащ се в плазмидите за експресия на Pfizer и Moderna, е под контрола на промотор на бактериофаг Т7. Не можем да приемем априори, че този промотор ще функционира в отсъствието на родствената му Т7 РНК полимераза. Въпреки това е експериментално потвърдено, че в действителност промоторът Т7 също се свързва с клетъчната РНК полимераза II и предизвиква експресия на протеини в клетките на бозайници[19].
В обобщение, възможността наблюдаваната дълготрайна експресия на шиповия протеин да е причинена от плазмидната ДНК, съдържаща се във ваксините с мРНК, трябва да се приема сериозно. Продължителното запазване на мРНК на шиповия протеин и неговата експресия след ваксинация, открити в биопсии и аутопсии, недвусмислено се свързват с тежки увреждания [14,20], които най-вероятно са опосредствани от имунна атака срещу клетките, експресиращи този чужд антиген. Пропускането на съответните експериментални изследвания във фазата на предклиничното изпитване, заедно с мащаба на това замърсяване, създава напълно неприемлив риск за безопасността.
4.2. рискове, свързани с регулаторните ДНК последователности, получени от SV40
Една от характеристиките, която е идентифицирана от МакКернан в плазмидите на Pfizer, но не и в експресионните плазмиди на Moderna [6], е промотор, получен от вируса SV40, който принадлежи към семейството на полиома (вж. раздел 4.2). Този промотор е разположен преди гена за резистентност към канамицин; и тъй като е активен в клетките на бозайници, протеинът, кодиран от този ген за резистентност, ще се експресира във всяка клетка, съдържаща тази ДНК. Подобно на протеина на шипа, този протеин е чужд антиген, така че също може да предизвика имунна атака на клетките, които го експресират.
Промоторът на SV40 включва и вътрешен произход на репликация, който потенциално може да доведе до появата на копия на плазмида в клетките на бозайници [21]. За целта е необходимо наличието на големия вирусен Т антиген– протеин, който директно разпознава това начало и след това инициира репликацията на ДНК молекулата. Този белтък не е кодиран от плазмида, нито пък нормално присъства в клетките на нашето тяло, но може да бъде осигурен или от самия вирус SV40, или от сроден полиома вирус. Малка част от човешката популация е латентно инфектирана с SV40 и тази латентна инфекция е свързана с някои злокачествени и незлокачествени заболявания[22]. Ако копие на плазмида на Pfizer бъде прието в клетка, която е носител на SV40, тогава ефективно могат да се образуват допълнителни негови копия.
Два сродни полиома вируса, които са много по-разпространени сред човешката популация, са BK и JC вирусът [23,24]. Големият Т антиген на JC очевидно е по-малко ефективен в съчетание с произхода на SV40, отколкото самият протеин на SV40 [25], но въпреки това не може да се изключи репликацията на плазмида на Pfizer в клетки, латентно заразени с JC или BK вируси. Допълнителните копия на плазмида, генерирани по този начин, биха засилили всички други рискове, разгледани в този раздел, с възможното изключение на неспецифичното възпаление (вж. раздел 4.4).
4.3. геномно вмъкване на плазмидна ДНК
Всички разгледани досега сценарии включват епизодично независимо запазване на плазмидна ДНК; тя ще присъства в близост до хромозомите (в рамките на клетъчното ядро), но няма да е станала неразделна част от никоя от тях. Такива независими, нереплициращи се плазмидни молекули обикновено се губят по време на клетъчното делене[26]. Въпреки това, както ще видим, в някои случаи плазмидната молекула може действително да се интегрира в една от хромозомите на клетката-приемник и след това да бъде наследена от всички потомци на тази клетка.
Хромозомната интеграция е форма на „генотоксичност“, т.е. токсичност, която причинява генетично увреждане. Що се отнася до възможността за такива ефекти, в доклада на EMA за оценка на mRNA ваксината на Pfizer се отбелязва лаконично[4, стр. 50]:
Не са представени изследвания за генотоксичност. Това е приемливо, тъй като компонентите на състава на ваксината са липиди и РНК, за които не се очаква да имат генотоксичен потенциал.
Очевидно експертите на ЕМА са приели, че РНК като цяло няма да засегне целостта на генома на клетките-гостоприемници. Това мнение е неправилно и първото доказателство, което го доказва, наскоро отбеляза своята петдесетгодишнина[27]. Въпреки това, откриването на големи количества плазмидна ДНК във ваксините на двамата производители вече не налага да се излагат такива доводи. Със сигурност дори учените от ЕМА ще са наясно, че тази ДНК може да се интегрира в генома на човешките клетки-гостоприемници. Не се изискват никакви специфични характеристики на последователността, за да се осъществи такава интеграция, и следователно тя е наблюдавана по същия начин с ДНК на вируси на бозайници, бактериофаги и плазмиди[28]. Заслужава да се отбележи, че такива вмъквания могат да се случат на произволни места в генома, но по-често се засягат гени, които се експресират активно от клетката[29].
Стабилната хромозомна интеграция на бактериален плазмид в хромозомната ДНК на клетките на бозайници е демонстрирана още през 1982 г.[30]. Въпросният плазмид има множество общи характеристики с тези, използвани при производството на мРНК ваксини на Moderna и Pfizer. Оттогава въвеждането на чужди или модифицирани гени в клетки на бозайници чрез тази и подобни техники е станало обичайно в експерименталните изследвания и биотехнологиите. Методологията се нарича трансфекция, а модифицираните по този начин организми – трансгени. Отбелязваме, че стабилна интеграция може да се осъществи както с линейна, така и с кръгова плазмидна ДНК [31].
В този контекст трябва да вземем предвид и публикуваното по-рано изследване на Алден и съавтори [32], които откриват ДНК копия на гена на шиповия протеин в човешка чернодробна клетъчна линия, след като тези клетки са били изложени на мРНК ваксина на Pfizer. Въз основа на предположението, че ваксината е съдържала по същество чиста мРНК, но не и ДНК, те приемат това наблюдение като доказателство, че синтетичната мРНК е претърпяла обратна транскрипция в тези клетки. Тяхното тълкуване е правдоподобно, тъй като е известно, че такава обратна транскрипция се случва по принцип и преди това е докладвана в клетки от пациенти, заразени с вируса SARS-CoV-2[33]. Въпреки това, в светлината на откритието на МакКернан, че флаконите с ваксини на Pfizer могат да съдържат значителни количества ДНК, изглежда също толкова възможно наблюденията на Aldén et al. просто да показват клетъчно усвояване на тази ДНК. Във всеки случай обаче техните констатации показват наличието на шипово-кодираща ДНК, в тези клетки, което показва риск от геномно вмъкване.
4.3.1 Геномно вмъкване при генна терапия с използване на ретровирусни вектори
При правилната генна терапия често се желае хромозомна интеграция, тъй като тя ще коригира трайно въпросния генетичен дефект. За тази цел са разработени специални ДНК вектори, които имат много по-голяма склонност да се подлагат на такава интеграция. Тези вектори произлизат от ретровируси, чиято цялостна стратегия за оцеляване се основава на геномната интеграция. Оказва се обаче, че интеграцията, когато се осъществява на неправилно място в генома, често предизвиква злокачествени заболявания, особено левкемия[34]. Всъщност това е толкова често срещано явление, че възпрепятства широкото разпространение на генната терапия, дори при заболявания, за които всички други терапевтични възможности са еднакво изпълнени с много сериозни рискове. Добър пример за това е дефицитът на аденозин деаминаза – метаболитно заболяване, което елиминира лимфоцитите, като по този начин причинява тежък комбиниран имунен дефицит (SCID) – състояние, което без лечение винаги е фатално в детска възраст. Това заболяване по принцип е много подходяща мишена за генна терапия, но трансплантацията на костен мозък от подходящ и сроден донор остава предпочитаната терапевтична възможност поради сериозния риск от злокачествени заболявания, предизвикани от генната терапия[35].
4.3.2 Как геномното вмъкване причинява злокачествени заболявания?
Нашият геном съдържа множество гени, които могат да доведат до появата на рак, ако нивото на тяхната експресия – скоростта, с която от тях се синтезират мРНК и белтъчни молекули – е твърде ниско или твърде високо. Може да се случи чужда ДНК молекула да се вмъкне директно в такъв ген и да го изключи напълно, или да се вмъкне до него и силен промотор, наличен в тази чужда ДНК, да предизвика свръхекспресия на въпросния ген. Освен това е наблюдавано, че случаите на вмъкване на гени могат да предизвикат и промени в ДНК метилирането в целия геном, което ще повлияе на нивата на експресия на много гени; и някои от тези промени могат да допринесат за индуциране на злокачествени заболявания. Важно е да се отбележи, че този ефект е наблюдаван не само при вирусна ДНК, но и при бактериални плазмиди[36].
Когато клетките се изолират от здрав човешки или животински орган и се отглеждат в клетъчна култура, те се делят за ограничен брой поколения и след това умират. За разлика от тях клетките, получени от злокачествени тумори и левкемии, могат да се размножават неограничено. Подобна промяна може да настъпи и в култивираните клетки, които по този начин се обезсмъртяват и обикновено губят и някои характеристики, характерни за тъканта на произхода им. Тази трансформация може да бъде предизвикана например чрез заразяване на клетките с гореспоменатия вирус SV40. По подобен начин клетките могат да бъдат трансформирани чрез трансфекция с плазмид, получен от SV40, който запазва ключовите части на вирусния геном, включително гена, кодиращ големия Т антиген. От друга страна, ако големият Т антиген отсъства от плазмида, трансформация обикновено не настъпва[30]. Въпреки това са докладвани някои изключения[37,38]. Тези случаи трябва да са възникнали в резултат на прекъсване или понижаване на регулацията на клетъчни гени, участващи в контрола на пролиферацията.
4.3.3 Геномна интеграция в зародишни клетки
Ооцитите могат да бъдат трансферирани in vivo на определени етапи от съзряването[39], както и спермопродуциращите клетки в тестисите[40]. В последния случай е доказано, че потомството на животни, подложени на такова третиране, е трансгенно. Следователно не може да се изключи, че хора, инжектирани с мРНК ваксини, които съдържат и ДНК, впоследствие ще доведат до появата на трансгенни деца. Вмъкването на ДНК в зародишните клетки може също така да попречи на ранното вътреутробно развитие и по този начин да предизвика спонтанни аборти или малформации.
4.3.4 Как трябва да се оценява рискът от вмъкване на геном?
Със сигурност е вярно, че бактериалните плазмиди имат по-малка склонност към вмъкване в нашата хромозомна ДНК, отколкото векторите за генна терапия, специално разработени за ефективна интеграция. Но колко точно голям е рискът в случая с плазмидите, съдържащи се във ваксините с мРНК? Простият отговор е, че никой не знае. Не защото не е известен по принцип, а защото не са проведени съответните експериментални изследвания върху животни, а впоследствие и върху хора; или ако са проведени, резултатите са били скрити от обществеността, а очевидно и от регулаторните органи.
Как биха били оценени подобни рискове при правилно проведени процедури за одобрение? Настоящото ръководство на FDA за тестване и одобрение на генни терапии[41] препоръчва във фазата на клинично тестване пациентите да бъдат наблюдавани в продължение на 15 години след приложението, като през първите пет години се провеждат ежегодни прегледи. Това се отнася за векторите, за които е предназначено хромозомното вмъкване. Документът с насоки продължава да изгражда фалшива дихотомия между вектори за вмъкване и вектори без вмъкване, но разделителната линия между тях остава неясна. От една страна, ръководният документ предполага, че
Продуктите за ГТ [генна терапия], които се основават на вектори като плазмиди … не са склонни да се интегрират или реактивират след латентност, като цяло имат по-малък риск от забавени нежелани събития,
но от друга страна се посочва, че
промените в методите, използвани за въвеждане на плазмидни ДНК вектори в клетките … водят до по-висока честота на интеграция (Реф. 27).
Референцията, цитирана в последния цитат, е проучване на Ланг и съавтори[42], които недвусмислено идентифицират вмъкване на плазмидна ДНК in vivo след интрамускулно инжектиране, което е последвано от електропорация. Въпреки че електропорацията е увеличила клетъчното усвояване на инжектираната ДНК в сравнение с инжектирането само на „гола“ ДНК, тя вероятно е била много по-малко ефективна в това отношение от липидните наночастици, съдържащи се в мРНК ваксините. Следователно трябва да се очаква известна хромозомна интеграция на замърсяващата плазмидна ДНК in vivo.
4.4. подсилващ възпалителен ефект на бактериалната ДНК
Човешката вродена имунна система реагира с възпаление на различни бактериални макромолекули, включително ДНК. Трябва да се има предвид, че големите количества ДНК, съдържащи се във ваксините, допринасят за възпалението в близост до мястото на инжектиране, а потенциално и на други места в тялото.
5. Заключение
Наличието на замърсяваща плазмидна ДНК в мРНК ваксините на Pfizer и Moderna води до сериозни рискове за здравето, в допълнение към вече известните и разбраните. Тези рискове включват продължителна експресия на шиповия протеин, която може да доведе до съответното и по-разрушително автоимунно възпаление, и предизвикване на злокачествено заболяване след хромозомна интеграция на плазмидната ДНК. Освен това мащабът на замърсяването доказва убедително, че производителите не са овладели или не са приложили правилно проектираните производствени процеси. Всеки от тези проблеми сам по себе си би бил достатъчна причина да се изисква незабавното изтегляне на тези ваксини.
Благодарности
Благодарим на Кевин МакКернан и Улрике Кемерер за корекциите и обсъжданията.
Авторско право
Този текст е лицензиран съгласно условията на международния лиценз Creative Commons Attribution 4.0 (CC BY 4.0). Това означава, че можете свободно да копирате и преизползвате съдържанието, при условие че са посочени оригиналните автори. Ако правите промени в текста, трябва изрично да посочите това. За повече подробности вижте уебсайта на Creative Commons[43].
Препратки
- Andries, O. et al. (2015) N1-метилпсевдоуридиновата инкорпорирана мРНК превъзхожда псевдоуридиновата-{}инкорпорирана мРНК, осигурявайки повишена протеинова експресия и намалявайки имуногенността в клетъчни линии на бозайници и мишки. J. Control.Release 217:337-344
- Анонимен, (2020 г.) Информационен документ на FDA: Ваксина COVID-19 на Pfizer-BioNTech.
- Анонимен, (2020 г.) Информационен документ на FDA : модерна MRNA-1273.
- Анонимен, (2021 г.) Доклад за оценка на ЕМА: Комисионен доклад за резултатите от проучването.
- Анонимен, (2021 г.) Доклад за оценка на ЕМА: Модерна ваксина COVID-19.
- McKernan, K. (2023) Deep sequencing of Moderna and Pfizer bivalent vaccines identifies contamination of expression vectors designed for plasmid amplification in bacteria (Дълбоко секвениране на бивалентни ваксини Moderna и Pfizer идентифицира замърсяване на експресионни вектори, предназначени за амплификация на плазмиди в бактерии).
- McKernan, K. (2023 г.) Двувалентните ваксини на Pfizer и Moderna съдържат 20-35% експресионни вектори и са компетентни за трансформиране на E.coli.
- McKernan, K. (2023) ДНК замърсяване в 8 флакона с моновалентни ваксини на Pfizer с мРНК.
- Patel, H.K. et al. (2023) Characterization of BNT162b2 mRNA to Evaluate Risk of Off-Target Antigen Translation (Характеризиране на мРНК BNT162b2 за оценка на риска от транслация на нецелеви антиген). J. Pharm.Sci. DOI:10.1016/j.xphs.2023.01.007
- Pardi, N. et al. (2018) Nucleoside-modified mRNA vaccines induce potent T follicular helper and germinal center B cell responses (Нуклеозид-модифицирани мРНК ваксини индуцират мощни отговори от Т фоликуларни помощни и В клетки от герминативния център). J. Exp. Med. 215:1571-1588
- Bansal, S. et al. (2021) Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies (Циркулиращи екзозозоми с протеин COVID Spike се индуцират от ваксинация с BNT162b2 (Pfizer-BioNTech) преди развитието на антитела): A Novel Mechanism of Immune Activation by mRNA Vaccines (Нов механизъм за имунно активиране чрез мРНК ваксини). J. Immunol. 207:2405-2410
- Castruita, J.A.S. et al. (2023) SARS-CoV-2 spike RNA ваксинални последователности циркулират в кръвта до 28 дни след ваксинация с COVID-19. APMIS 131:128-132
- Fertig, T.E. et al. (2022) Vaccine mRNA can be detected in blood at 15 days post-vaccination (Ваксинална мРНК може да се открие в кръвта 15 дни след ваксинацията). Biomedicines 10:1538
- Magen, E. et al. (2022) Клинична и молекулярна характеристика на рядък случай на миозит, свързан с ваксината BNT162b2 mRNA COVID-19. Ваксини 10
- Röltgen, K. et al. (2022) Имунен импринтинг, амплитуда на разпознаване на варианти и отговор на герминативния център при човешка SARS-CoV-2 инфекция и ваксинация. Cell DOI:10.1016/j.cell.2022.01.018
- Miao, C.H. et al. (2001) Дългосрочна и терапевтично ниво на чернодробна генна експресия на човешки фактор IX след трансфер на гол плазмид in vivo. Mol. Ther. 3:947-57
- Ye, X. et al. (2003) Пълна и устойчива фенотипна корекция на хемофилия В при мишки след чернодробен генен трансфер на плазмид с висока експресия на човешки фактор IX. J. Thromb. Haemost. 1:103-11
- Jager, L. и Ehrhardt, A. (2009 г.) Персистенция на аденовирусни вектори с висока производителност като мономерни геноми с дефектна репликация in vitro и в черен дроб на мишки. Hum.Gene Ther. 20:883-96
- Li, Y.Q. et al. (2000) [The function of T7 promoter as cis-acting elements for polymerase II in eukaryotic cells (Функцията на промотора Т7 като цис-действащ елемент за полимераза II в еукариотни клетки)]. Yi Chuan Xue Bao 27:455-61
- Mörz, M. (2022 г.) Доклад за случай: Некротизиращ енцефалит и мултифокален миокардит след ваксинация с BNT162b2 mRNA срещу Covid-19. Vaccines 10:2022060308
- Byrne, B.J. et al. (1983) Определяне на ранния промоторен регион на симиански вирус 40 и доказване на отклонение в обхвата на гостоприемника при усилващия ефект на повторението на 72-базовата двойка на симиански вирус 40. Proc.Natl.Acad.Sci.U. S. A. 80:721-5
- Rotondo, J.C. et al. (2019) Association Between Simian Virus 40 and Human Tumors (Асоциация между симийски вирус 40 и човешки тумори). Front.Oncol. 9:670
- DeCaprio, J.A. and Garcea, R.L. (2013) A cornucopia of human polyomaviruses (Рог на изобилието на човешките полиомавируси). Nat.Rev. Microbiol. 11:264-76
- Hussain, I. et al. (2020) Human BK and JC polyomaviruses: molecular insights and prevalence in Asia (Човешките полиомавируси BK и JC: молекулярни познания и разпространение в Азия). Virus Res. 278:197860
- La Bella, F. and Ozer, H.L. (1985) Differential replication of SV40 and polyoma DNAs in Chinese hamster ovary cells (Диференциална репликация на ДНК на SV40 и полиома в яйчникови клетки на китайски хамстер). Virus Res. 2:329-44
- Ehrhardt, A. et al. (2003) Епизомална устойчивост на геномите на рекомбинантни аденовирусни вектори по време на клетъчния цикъл in vivo. J. Virol. 77:7689-95
- Baltimore, D. (1970) RNA-dependent DNA polymerase in RNA tumor virus virions (РНК-зависима ДНК полимераза във вириони на туморни вируси). Nature 226:1209-11
- Doerfler, W. (2016) Beware of genome manipulations: epigenetic destabilization via (foreign) DNA insertions (Пазете се от манипулации на генома: епигенетична дестабилизация чрез вмъкване на (чужда) ДНК). Epigenomics 8:587-91
- Doerfler, W. (1996) A new concept in (adenoviral) oncogenesis: foreign DNA integration and its consequences (Нова концепция в (аденовирусната) онкогенеза: интеграция на чужда ДНК и нейните последствия). Biochim.Biophys.Acta 1288:F79-99
- Southern, P.J. and Berg, P. (1982) Трансформация на клетки на бозайници до антибиотична резистентност с бактериален ген под контрола на промотора на ранния регион на SV40. J. Mol. Appl. Genet. 1:327-41
- Stuchbury, G. and Münch, G. (2010) Оптимизиране на генерирането на стабилни невронни клетъчни линии чрез предварително трансфериране на ДНК на плазмиди чрез рестрикционен ензим. Цитотехнология 62:189-94
- Aldén, M. et al. (2022 г.) Вътреклетъчна обратна транскрипция на mRNA ваксина Pfizer BioNTech COVID-19 BNT162b2 in vitro в човешка чернодробна клетъчна линия. Curr.Emite Mol.Biol. 44:1115-1126
- Zhang, L. et al. (2020) SARS-CoV-2 RNA транскрибирана и интегрирана в човешкия геном. bioRxiv DOI:10.1101/2020.12.12.422516
- Staal, F.J.T. et al. (2008) Sola dosis facit venenum. Левкемия при изпитванията за генна терапия: въпрос на вектори, вмъквания и дозировка? Leukemia 22:1849-1852
- Kohn, D.B. and Gaspar, H.B. (2017) How We Manage Adenosine Deaminase-Defeficient Severe Combined Immune Deficiency (ADA SCID) (Как управляваме тежкия комбиниран имунен дефицит с аденозин деаминаза). J. Clin. Immunol. -n/a
- Doerfler, W. et al. (2018) Inheritable epigenetic response towards foreign DNA entry by mammalian host cells: a guardian of genomic stability (Наследствен епигенетичен отговор към навлизането на чужда ДНК от клетките-гостоприемници на бозайници: пазител на геномната стабилност). Epigenetics 13:1141-1153
- Sipehia, R. and Martucci, G. (1995) Високоефективна трансформация на човешки ендотелни клетки чрез Apo E-медиирана трансфекция с плазмидна ДНК. Биохимия.Biophys.Commun.Res. 214:206-11
- Takahashi, M. et al. (2002) Трансформация на MC3T3-E1 клетки след стрес и трансфекция с плазмид pSV2neo. Anticancer Res. 22:585-98
- Laurema, A. et al. (2003) Transfection of oocytes and other types of ovarian cells in rabits after direct injection into uterine arteries of adenoviruses and plasmid/liposomes (Трансфекция на яйцеклетки и други видове яйчникови клетки при зайци след директно инжектиране в маточните артерии на аденовируси и плазмиди/липозоми). Gene Ther. 10:580-4
- Dhup, S. and Majumdar, S.S. (2008) Transgenesis through permanent gene integration in spermatogonial cell repopulation in vivo (Трансгенеза чрез постоянно интегриране на гени при репопулация на сперматозоидни клетки in vivo). Nat.Methods 5:601-3
- Анонимен, (2020) Дългосрочно проследяване след прилагане на продукти за човешка генна терапия: Ръководство за индустрията.
- Wang, Z. et al. (2004) Detection of integration of plasmid DNA into host genomic DNA following intramuscular injection and electroporation (Откриване на интеграция на плазмидна ДНК в геномна ДНК на гостоприемника след интрамускулно инжектиране и електропорация). Генна терапия. 11:711-21
- Anonymous, (2023) Creative Commons Признание 4.0 Международен лиценз (CC BY 4.0).
Първоначално публикувано в Doctors for Covid Ethics
Suggest a correction