As vacinas COVID-19 mRNA contêm quantidades excessivas de ADN bacteriano: provas e implicações
Estudos recentes de Kevin McKernan, um perito líder em métodos de sequenciação de ADN e ARN, revelaram que os lotes das vacinas de mRNA modificadas produzidas tanto pela Pfizer como pela Moderna contêm uma elevada proporção de ADN bacteriano contaminante. No total, o ADN representa até 20-35% dos ácidos nucleicos contidos em cada um dos lotes de vacinas. Estas concentrações alarmantemente elevadas excedem de longe os níveis considerados seguros por organizações de normalização como a Agência Europeia de Medicamentos (EMA). Este documento resume as provas desta contaminação por ADN e discute os possíveis riscos para a saúde de quem recebe as vacinas.
1. O papel do ADN no fabrico da vacina mRNA
1.1. Antecedentes gerais
A maioria dos leitores estará ciente de que
- os RNAs sintéticos contidos nas vacinas COVID-19 mRNA codificam a proteína spike SARS-CoV-2;
- em células de mamíferos vivos, as instruções para a construção de uma dada molécula de proteína são armazenadas como um gene dentro do ADN no interior do núcleo;
- para construir uma dada molécula de proteína, a célula primeiro transcreve o seu gene em RNA e modifica as duas extremidades desta molécula para formar o RNA mensageiro (mRNA). O mRNA é então transportado do núcleo para o citoplasma, onde induz as fábricas de proteína da célula – os ribossomas – a traduzir a sequência nucleotídica do mRNA para a sequência de aminoácidos correspondente e montar a proteína.
1.2. Etapas na fabricação da vacina contra o mRNA
Uma vez que a proteína spike é uma molécula grande, o mRNA que a codifica também o é. A síntese química total de moléculas de mRNA grandes não é prática à escala. Portanto, para obter o pico de codificação da molécula de mRNA, o processo pelo qual as células produzem os seus próprios mRNAs é imitado in vitro. Isto envolve os seguintes passos:
- Uma cópia do ADN do gene para a proteína spike é inserida num plasmídeo bacteriano. Esta é uma molécula de ADN em forma de anel, de dupla cadeia, que pode existir numa célula bacteriana independentemente do próprio ADN cromossómico da célula, e que também pode ser copiada e transmitida a ambas as células filhas quando essa célula se divide.
- O plasmídeo recombinante (artificial) portador do gene da proteína spike é introduzido numa célula da espécie bacteriana Escherichia coli(E. coli ). Uma vez que as células de E. coli se dividem muito rapidamente, esta única célula pode, num curto espaço de tempo, crescer a um número muito grande de células. Cada uma destas células progenitoras conterá as suas próprias cópias herdadas do plasmídeo e, portanto, do gene da proteína spike. Embora haja uma certa probabilidade de que o plasmídeo se perca de algumas das descendentes durante as sucessivas divisões celulares, podemos impor a sua manutenção dando-lhe um marcador seleccionável, que assegura que apenas as células que retêm o plasmídeo sobreviverão. Com os plasmídeos utilizados tanto pela Pfizer como pela Moderna, este marcador seleccionável é um gene que dá às células hospedeiras resistência ao antibiótico canamicina. Para aplicar a selecção, as bactérias são simplesmente cultivadas na presença da canamicina.
- Após o cultivo de um número suficiente de células bacterianas num caldo de nutrientes contendo canamicina, estas células são decompostas e o ADN plasmídeo é purificado a partir dos outros componentes das células bacterianas.
- As moléculas de plasmídeo em forma de anel são convertidas em forma linear utilizando uma enzima de restrição, que fende ambas as vertentes da molécula de ADN num local específico e único a jusante do gene da proteína spike. Este passo é necessário para prevenir a formação de moléculas de RNA que são demasiado longas e podem ter efeitos indesejáveis em vivo. As moléculas de ADN linearizadas podem ser purificadas a partir das moléculas circulares restantes, mas como e quão eficientemente isto pode ser feito na produção das vacinas da Pfizer e da Moderna não é conhecido publicamente.
- Uma polimerase de RNA é utilizada, na presença dos blocos de construção e cofactores nucleosídeos necessários, para copiar o gene da proteína spike da versão do ADN no plasmídeo linearizado para a versão do mRNA. Tanto Pfizer como Moderna empregam a polimerase de RNA T7, que é derivada da bacteriófago epónimo. Esta enzima liga-se a uma sequência promotora cognata, também derivada de T7, a qual foi concebida no plasmídeo a montante do gene da proteína spike. Esta interacção entre a polimerase e o promotor inicia a transcrição. Nesta fase, o nucleósido sintético N-metil-pseudouridina (mψU) é incorporado no RNA artificial em vez do nucleósido natural da uridina. Quando administrado sob a forma de vacina, o RNA modificado desta forma é menos estimulante para o sistema imunitário inato do que o RNA que contém a uridina natural. Também se traduz mais eficazmente em proteínas, e sob certas condições é mais resistente à degradação[1]. Tanto as vacinas Pfizer como o mRNA da Moderna contêm mψU em vez de uridina.
- As duas extremidades de cada molécula de RNA são enzimaticamente acopladas a certas moieties que também se encontram nestas posições dentro dos mRNAs naturais de mamíferos, e que aumentam a sua actividade biológica e estabilidade em vivo.
Estas etapas proporcionam um mRNA funcional capaz de instruir os ribossomas das células a produzir a proteína spike. No entanto, nesta fase, o produto ainda não é puro – todo o ADN modelo derivado de bactérias ainda está presente. Este último não deve ser incluído no produto final do medicamento, porque representa riscos para a saúde dos receptores (ver secção 4). Para se livrar deste ADN, outra enzima chamada DNase é adicionada. Esta deve decompor o ADN em fragmentos mais pequenos, que podem depois ser removidos das moléculas de RNA muito maiores através de filtragem e outras técnicas de purificação. Na etapa final, o mRNA é combinado com uma mistura lipídica para o acondicionar em nanopartículas lipídicas (LNPs), que induzem as células humanas a absorverem a molécula de mRNA e a fazer a proteína spike.
2. O que sabíamos anteriormente sobre o problema da contaminação do ADN?
Em suma, muito pouco. Os relatórios de avaliação da FDA sobre ambas as vacinas[2,3] não mencionam de todo a questão. O relatório de avaliação da Agência Europeia de Medicamentos (EMA) sobre a vacina Pfizer menciona que “A robustez da etapa de digestão do DNase não é considerada exaustivamente demonstrada”[4, p. 17]. Linguagem semelhante é utilizada no relatório da EMA sobre a vacina Moderna[5, p. 19f]. No entanto, com base apenas nesta escassa informação, é impossível dizer se o problema foi considerado grave, e que remédios foram exigidos pelo regulador, se é que houve algum.
3. Provas independentes sobre a contaminação por ADN de produtos de mRNA
Desde 3 de Abril de 2023, Kevin McKernan descreveu as suas recentes descobertas em três artigos no seu website Subtack[6-8]. As experiências descritas nos dois primeiros relatórios foram realizadas em amostras de vacinas “bivalentes” recentemente introduzidas pela Pfizer e Moderna. Estas preparações assemelham-se às “monovalentes” anteriores na sua composição química, ou seja, devem conter mRNA altamente puro, complexado com uma mistura de moléculas lipídicas (semelhantes a gordura) em nanopartículas de mRNA/lipídicas. A única diferença entre as duas variedades é que as vacinas bivalentes contêm uma mistura de dois mRNAs que codificam duas variantes antigénicas da proteína spike. Isto não tem qualquer relação com o problema técnico da contaminação do ADN enquanto tal. Contudo, notamos que a extensão da contaminação do ADN pode variar entre lotes de produção, e que até agora apenas um pequeno número de lotes tem sido caracterizado a este respeito.
3.1. O primeiro relatório de McKernan
Num estudo inicial[6], McKernan caracterizou tanto o RNA como o ADN contidos nas vacinas mRNA.
3.1.1 Extracção e caracterização directa dos ácidos nucleicos das vacinas
O primeiro passo foi remover os lípidos a fim de obter os ácidos nucleicos puros. O método baseado em solventes utilizado não discrimina entre ADN e RNA – se ambos estiverem presentes, ambos serão recuperados. Os ácidos nucleicos extraídos foram separados de acordo com o tamanho. Isto revelou não só as espécies regulares esperadas de mRNA de pico completo, mas também fragmentos mais pequenos, que tinham sido previamente notados tanto pelos reguladores como em trabalhos publicados por um dos fabricantes[9]. Mais surpreendentemente, foram também encontradas espécies de RNA maiores do que o mRNA de pleno comprimento. Estas espécies permanecem não caracterizadas.
3.1.2 Amplificação dos ácidos nucleicos extraídos
Como passo preparatório para determinar as sequências exactas de nucleótidos dos ácidos nucleicos extraídos, estes foram amplificados por métodos de PCR. No caso do RNA, o PCR foi precedido de transcrição reversa em ADN, utilizando uma enzima dedicada (transcriptase reversa). Uma vez que o objectivo principal deste estudo era estudar o RNA e não o ADN, esta etapa de amplificação foi tendenciosa quanto ao ADN pela adição de actinomicina D, que sob as condições experimentais dadas inibe selectivamente a síntese de ADN. Assim, quantidades relativamente baixas de ADN foram recuperadas na amostra amplificada. Contudo, no caso da vacina Pfizer, a quantidade de ADN presente já excedeu o limite arbitrariamente decidido pela EMA para a relação máxima admissível de ADN para RNA.
3.1.3 Resultados da sequenciação de ADN
Com os produtos Pfizer e Moderna, foram obtidas sequências de ADN de plasmídeos de ADN completos, embora alguma ambiguidade permaneceu no caso dos plasmídeos da Moderna. As características das sequências plasmídicas serão portanto discutidas em conexão com o segundo estudo de McKernan, que utilizou cada vez mais ADN puro para a sequenciação e, por conseguinte, forneceu resultados mais fiáveis.
3.2. O segundo relatório de McKernan
O segundo estudo[7] centrou-se na quantificação e caracterização da contaminação do ADN que foi qualitativamente detectada no primeiro.
3.2.1. O ADN plasmídeo contido nas vacinas de mRNA é competente para se propagar em células bacterianas
Na primeira experiência, foi determinado se o ADN plasmídeo cuja presença tinha sido inferida a partir dos resultados da sequência anterior é de facto biologicamente funcional, na medida em que pode ser introduzido e persistir dentro das células bacterianas. Para este fim, os ácidos nucleicos foram novamente extraídos das amostras da vacina. Estes ácidos nucleicos foram misturados com uma suspensão de células de E. coli que tinham sido tornadas competentes para a captação de ADN.
Após induzir estas células a absorverem o ADN e dando-lhes algum tempo para recuperarem, foram espalhadas em placas de Petri preenchidas com um meio de crescimento solidificado contendo canamicina. Como já foi referido anteriormente, a canamicina matará qualquer célula de E. coli que não contenha um gene de resistência à mesma. Portanto, o crescimento observado de colónias bacterianas nestas placas de Petri confirmou que algumas células tinham de facto adquirido resistência à canamicina ao absorverem e espalharem os plasmídeos. Isto foi observado tanto com as amostras das vacinas da Pfizer como da Moderna.
Neste contexto, devemos notar que apenas moléculas plasmídicas circulares, mas não linearizadas, podem ser eficazmente introduzidas nas células bacterianas. O sucesso desta experiência sugere, portanto, que algumas das moléculas plasmídicas escaparam ao passo da linearização (passo 4 na secção 1.2) e passaram por todo o processo de produção sob a forma circular que existe nas células bacterianas. Por outro lado, como o número de colónias bacterianas observadas nesta experiência não foi elevado, é provável que a maior parte do ADN tenha sido de facto linearizado. Uma vez que os perigos biológicos do ADN estranho dentro do nosso próprio corpo podem variar dependendo de ser linear ou circular, a presença provável de ambas as formas nas vacinas é digna de nota. As proporções exactas do ADN circular e linear nas misturas ainda estão por ser determinadas.
3.2.2 A abundância de ADN contaminante
A segunda grande descoberta deste estudo é a quantificação por PCR tanto do ADN como do mRNA contidos nas amostras de vacina. Como se deve saber, numa reacção PCR, um segmento escolhido de uma sequência de ácido nucleico é reduzido por síntese enzimática ao longo de vários ciclos de reacção sucessivos. A partir do número de ciclos (ou duplicações) necessários para atingir uma determinada concentração limite, podemos calcular quantas cópias da sequência alvo estavam presentes no início.
Nestas experiências, o formato experimental escolhido foi a PCR multiplex, ou seja, duas sequências alvo foram amplificadas numa única mistura de reacção. Um destes alvos estava dentro do gene da proteína spike, e assim deveria estar presente tanto nas moléculas de ADN plasmídeo como nas moléculas de mRNA spike transcritas a partir delas. A fim de incluir as moléculas de mRNA nesta amplificação, a PCR foi novamente precedida por transcrição inversa.
A outra sequência alvo estava dentro do gene de resistência à canamicina, que só deveria estar presente no ADN plasmídeo. Comparando o número de ciclos necessários para cada um dos dois alvos atravessar o limiar, determinou-se que até 35% do ácido nucleico total contido nas vacinas é na realidade ADN. Para comparação, a EMA estipulou que o ADN não deve ser superior a 0,033% do total de ácidos nucleicos.
3.2.3 Determinação das sequências de ADN plasmídico
Os plasmídeos que tinham sido originalmente contidos nas vacinas e depois introduzidos nas células bacterianas (ver secção 3.2.1) foram novamente isolados destas culturas bacterianas, e as suas sequências completas de ADN foram determinadas. Tais sequências foram fornecidas na íntegra no primeiro estudo de McKernan[6], mas ele indicou que ainda estava a trabalhar na corroboração e refinamento dos dados da sequenciação. Entretanto, as características funcionais do ADN plasmídeo encontrado nas amostras da vacina Pfizer são mostradas na Figura 1. Elas serão discutidas em conexão com a avaliação de risco.
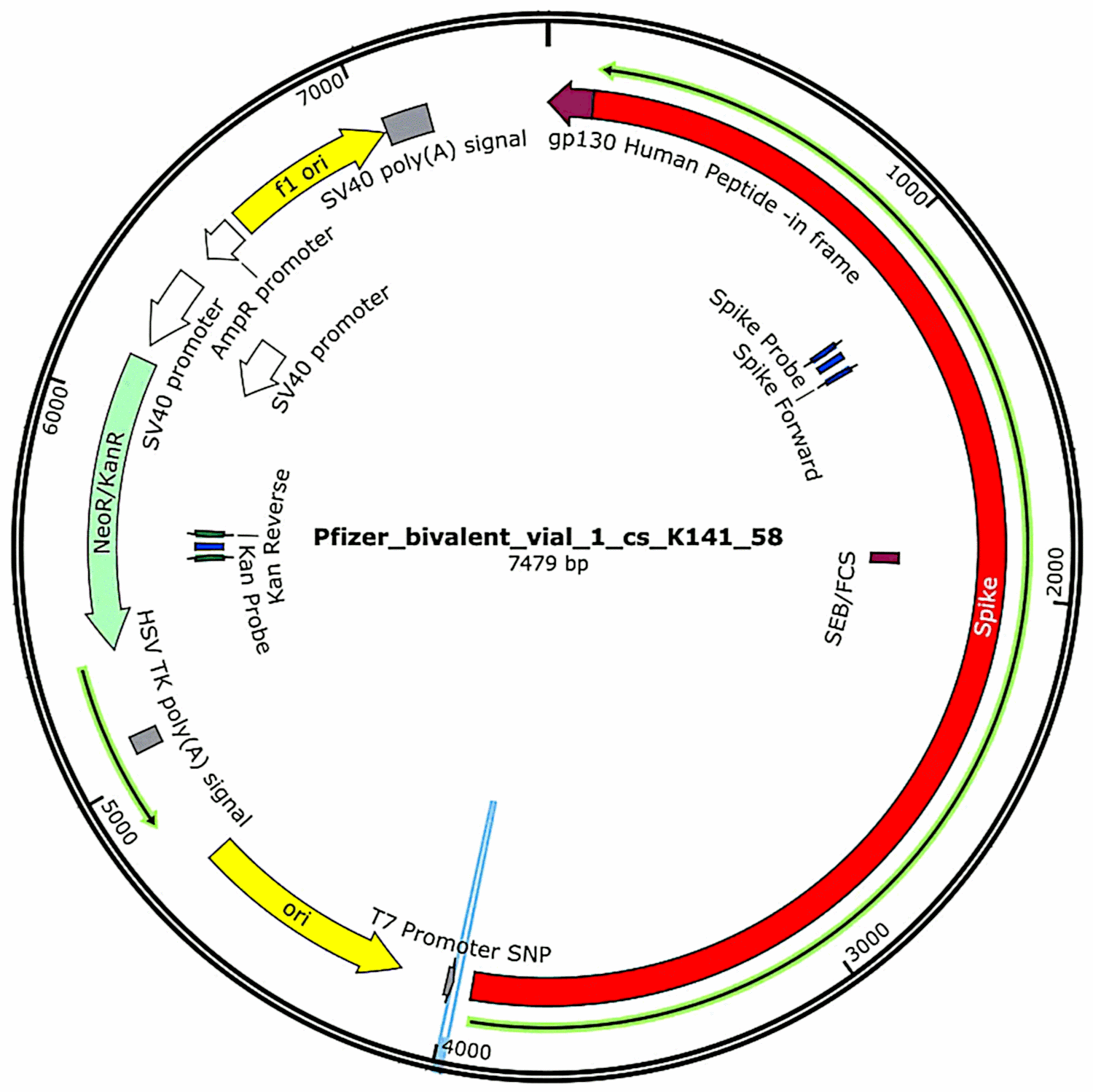
3.3. O terceiro relatório de McKernan
No seu relatório mais recente até à data, McKernan examinou oito frascos de um lote anterior da vacina Pfizer utilizando o método de PCR quantitativo descrito acima. O conteúdo de ADN neste caso era marcadamente inferior ao das amostras de vacina bivalentes, mas ainda assim excedeu o limite de EMA por um factor de 18-70[8].
4. Avaliação de risco
Devemos assumir que o ADN recombinante encontrado nas vacinas mRNA pode ser introduzido nas células do nosso corpo, e que isto será auxiliado por nanopartículas lipídicas, tal como acontece com o próprio mRNA. Isto representa vários tipos diferentes de riscos para a saúde.
4.1. prolongamento da duração da expressão da proteína spike
Um argumento-chave que é regularmente utilizado para promover a percepção da segurança da vacina contra o mRNA é que o mRNA é de curta duração in vivo, e que a expressão do antigénio codificado será, portanto, também de curta duração. Por exemplo, o relatório de avaliação da EMA sobre a vacina Pfizer afirma, em relação a experiências com animais em uma vacina modelo, que foram aceites em vez de estudos adequados sobre a própria vacina COVID-19[4, p. 46]:
Como esperado com um produto de mRNA, a expressão luciferase foi transitória … O sinal diminuiu lentamente durante as primeiras 72 horas e após 6 e 9 dias os sinais foram ainda mais enfraquecidos para níveis aproximadamente 18 e 7 vezes superiores aos sinais obtidos a partir de animais injectados com controlo tamponado.
Estes resultados parecem concordar com dois estudos in vitro que compararam a duração da expressão proteica entre espécies de RNA mensageiro que eram idênticas em sequência mas continham uridina ou mψU, respectivamente; como já foi referido, este último está também presente nas vacinas mRNA Pfizer e Moderna. Em ambos os estudos[1,10], as espécies de RNA modificadas de mψU induziram níveis significativamente mais elevados de expressão proteica, contudo, esta alta expressão diminuiu com uma meia-vida semelhante à do RNA não modificado. Nenhuma das meias-vidas que podem ser inferidas a partir dos dados em qualquer dos estudos excede 4,5 dias.
É, no entanto, claro a partir de múltiplos estudos sobre indivíduos vacinados que tanto a própria proteína spike como os ácidos nucleicos que a codificam podem ser detectados, na corrente sanguínea e em vários órgãos, durante semanas e até meses após a injecção[11-15]. Esta discrepância entre os estudos em vitro e em vivo tem sido até agora difícil de compreender. Os elevados níveis de DNA plasmídeo residual nas vacinas detectadas por McKernan sugerem agora uma explicação plausível.
Para que o ADN plasmídico bacteriano apoie a expressão prolongada da proteína spike, duas condições devem ser satisfeitas:
- o ADN plasmídeo deve persistir dentro das células do nosso corpo, e
- o gene da proteína spike nesse plasmídeo deve ser transcrito em mRNA pela nossa própria RNA polimerase celular II.
Embora ainda não disponhamos de quaisquer dados experimentais directos sobre a Pfizer e os plasmídeos de expressão dos spikes modernos, os precedentes sugerem que, de facto, ambos os requisitos são cumpridos. Verificou-se que os plasmídeos recombinantes que expressam o factor de coagulação IX persistem nas células hepáticas de animais experimentais a níveis estáveis até 1,5 anos,[16,17] o que correspondeu à duração total da experiência. Poder-se-ia objectar que os plasmídeos utilizados nestes estudos eram circulares, enquanto a maioria do ADN plasmídeo contido nas vacinas de mRNA é provavelmente de forma linear (ver secção 1.2). Em resposta, notamos que, em primeiro lugar, provavelmente permanece algum ADN plasmídeo circular (ver secção 3.2.1), e, em segundo lugar, que o ADN viral recombinante tem demonstrado persistir na forma linear dentro de animais durante períodos de tempo igualmente longos[18], sugerindo que o mesmo pode ser válido para o ADN plasmídeo.
Nos estudos citados[16,17], o gene que codifica a proteína de interesse (factor IX) tinha estado sob o controlo de um promotor mamífero, e de facto a proteína do factor IX foi expressa a níveis estáveis durante todo o tempo. Em contraste, o gene da proteína spike contida nos plasmídeos de expressão Pfizer e Moderna está sob o controlo de um promotor bacteriófago T7. Não podemos assumir a priori que este promotor funcionará na ausência da sua cognata RNA polimerase T7. Foi, contudo, experimentalmente confirmado que, de facto, o promotor T7 também liga a RNA polimerase II celular e provoca a expressão de proteínas em células de mamíferos[19].
Em resumo, a possibilidade de a expressão observada de longa duração da proteína spike ser causada pelo DNA plasmídeo contido nas vacinas do mRNA deve ser levada a sério. A persistência prolongada do mRNA da proteína spike e a sua expressão após a vacinação, detectada em biópsias e autópsias, tem sido inequivocamente associada a danos severos[14,20], o que é muito provavelmente mediado por um ataque imunitário às células que exprimem este antigénio estranho. A omissão de estudos experimentais correspondentes na fase de testes pré-clínicos, juntamente com a escala desta contaminação, cria um risco de segurança totalmente inaceitável.
4.2. Riscos associados a sequências de ADN regulamentadas derivadas do SV40
Uma característica que foi identificada por McKernan nos plasmídeos Pfizer mas não nos plasmídeos de expressão Moderna[6] é um promotor derivado do vírus SV40, que pertence à família dos poliomas (ver secção 4.2). Este promotor está localizado a montante do gene de resistência à canamicina; e uma vez que é activo em células de mamíferos, a proteína codificada por este gene de resistência será expressa em qualquer célula que contenha este ADN. Tal como a proteína spike, esta proteína é um antigénio estranho, pelo que também pode desencadear um ataque imunitário sobre as células que a exprimem.
O promotor SV40 também inclui uma origem de replicação interna que pode potencialmente causar cópias do plasmídeo dentro das células de mamíferos[21]. Isto exigirá a presença do grande antigénio viral T, uma proteína que reconhece directamente esta origem e depois inicia a replicação da molécula de ADN. Esta proteína não é codificada pelo plasmídeo, nem está normalmente presente nas células do nosso corpo, mas pode ser fornecida ou pelo próprio vírus SV40 ou por um vírus de polioma relacionado. Uma minoria da população humana está latentemente infectada pelo SV40, e esta infecção latente está associada a algumas doenças malignas e não malignas[22]. Se uma cópia do plasmídeo Pfizer for levada para uma célula que alberga o SV40, então podem ser efectivamente formadas cópias adicionais do mesmo.
Dois vírus relacionados com o polioma que estão muito mais disseminados na população humana são os vírus BK e JC[23,24]. O antigénio JC grande T é aparentemente menos eficaz em conjunto com a origem SV40 do que a própria proteína SV40[25], mas a replicação do plasmídeo Pfizer em células latentemente infectadas com vírus JC ou BK não pode, contudo, ser excluída. Cópias adicionais do plasmídeo gerado desta forma amplificariam todos os outros riscos discutidos nesta secção, com a possível excepção de inflamação não específica (ver secção 4.4).
4.3. Inserção genómica do ADN plasmídeo
Os cenários discutidos até agora envolvem todos a persistência episódica independente do ADN plasmídeo; este estará presente perto dos cromossomas (dentro do núcleo celular), mas não se terá tornado parte integrante de nenhum deles. Tais moléculas plasmídicas independentes e não replicantes tenderão a perder-se durante a divisão celular[26]. No entanto, como veremos, em alguns casos, uma molécula plasmídica pode efectivamente ser integrada num dos cromossomas da sua célula hospedeira, e será então herdada por todos os descendentes dessa célula.
A integração dos cromossomas é uma forma de “genotoxicidade”, ou seja, toxicidade que causa danos genéticos. Quanto à possibilidade de tais efeitos, o relatório de avaliação da EMA sobre a vacina Pfizer mRNA observa sucintamente[4, p. 50]:
Não foram fornecidos estudos de genotoxicidade. Isto é aceitável, uma vez que os componentes da formulação da vacina são os lípidos e o RNA que não se espera que tenham potencial genotóxico.
Aparentemente, os peritos da EMA estavam a assumir que o RNA em geral não irá afectar a integridade do genoma da célula hospedeira. Este ponto de vista é incorrecto, e as primeiras evidências que o provam celebraram recentemente o seu quinquagésimo aniversário[27]. Contudo, a detecção de quantidades copiosas de ADN plasmídeo nas vacinas de ambos os fabricantes torna óbvio agora a necessidade de apresentar esse caso. Certamente até os cientistas da EMA estarão cientes de que este ADN pode ser integrado no genoma das células hospedeiras humanas. Não são necessárias características de sequência específicas para que tal integração ocorra e, consequentemente, tem sido observada da mesma forma com ADN de vírus de mamíferos, bacteriófagos, e plasmídeos[28]. Vale a pena notar que tais inserções podem ocorrer em locais aleatórios do genoma, mas os genes que estão a ser activamente expressos pela célula são mais frequentemente afectados[29].
A integração cromossómica estável de um plasmídeo bacteriano no DNA cromossómico de células de mamíferos foi demonstrada já em 1982[30]. O plasmídeo em questão partilha múltiplas características com as utilizadas na produção das vacinas mRNA da Moderna e da Pfizer. A introdução de genes estranhos ou modificados em células de mamíferos, utilizando esta e outras técnicas semelhantes, tornou-se desde então comum na investigação experimental e biotecnologia. A metodologia é referida como transfecção, e os organismos modificados desta forma como transgénicos. Observamos que a integração estável pode ocorrer tanto com o ADN plasmídeo linear como circular[31].
Neste contexto, devemos também considerar o estudo anteriormente publicado por Aldén et al.[32], que detectou cópias de ADN do gene da proteína spike numa linha de células do fígado humano após estas células terem sido expostas à vacina Pfizer mRNA. Com base no pressuposto de que a vacina continha essencialmente mRNA puro mas não ADN, tomaram esta observação como prova de que o mRNA sintético tinha sido submetido a transcrição reversa dentro destas células. A sua interpretação é plausível, porque tal transcrição reversa é conhecida por ocorrer em princípio e foi previamente notificada em células de doentes infectados com o vírus SARS-CoV-2[33]. Contudo, à luz da descoberta de McKernan de que os frascos de vacinas Pfizer podem conter quantidades substanciais de ADN, parece igualmente possível que as observações de Aldén et al. tenham simplesmente indicado a absorção celular deste ADN. Em qualquer caso, contudo, as suas descobertas indicam a presença de ADN codificador de spikes dentro destas células, o que indica um risco de inserção genómica.
4.3.1 Inserção genómica na terapia génica utilizando vectores retrovirais
Na terapia genética adequada, a integração cromossómica é frequentemente desejada, uma vez que corrigirá o defeito genético em questão de uma forma duradoura. Para este fim, foram desenvolvidos vectores especiais de ADN que têm uma propensão muito maior para sofrer tal integração. Estes vectores são derivados de retrovírus, cuja estratégia de sobrevivência completa se baseia na integração genómica. Acontece, contudo, que a integração, quando ocorre no lugar errado dentro do genoma, induz frequentemente doenças malignas, especialmente a leucemia[34]. De facto, isto é tão comum que tem impedido a adopção generalizada da terapia genética, mesmo em doenças para as quais todas as outras opções terapêuticas estão igualmente carregadas de riscos muito sérios. Um bom exemplo é a deficiência de deaminase adenosina, uma doença metabólica que elimina linfócitos, causando assim uma grave deficiência imunológica combinada (SCID), uma condição que sem tratamento é sempre fatal durante a infância. Esta doença é, em princípio, um alvo muito adequado para a terapia genética, mas um transplante de medula óssea de um doador compatível e relacionado continua a ser a opção terapêutica preferida devido ao risco grave de malignidades induzidas pela terapia genética[35].
4.3.2 Como é que a inserção genómica causa malignidades?
O nosso genoma contém múltiplos genes que podem dar origem a cancro se o seu nível de expressão – o ritmo a que o mRNA e as moléculas proteicas são sintetizadas a partir deles – for demasiado baixo ou demasiado alto. Pode acontecer que uma molécula de ADN estranha se insira directamente em tal gene e o elimine completamente, ou que se insira junto a ele, e um forte promotor presente nesse ADN estranho pode causar uma sobreexpressão do gene em questão. Além disso, observou-se que os eventos de inserção também podem causar alterações ao nível do genoma na metilação do ADN, o que afectará os níveis de expressão de muitos genes; e algumas destas alterações podem contribuir para a indução de malignidade. É importante notar que este efeito tem sido observado não só no DNA viral, mas também nos plasmídeos bacterianos[36].
Quando as células são isoladas de um órgão humano ou animal saudável e crescem em cultura celular, dividem-se durante um número limitado de gerações e depois morrem. Em contraste, as células derivadas de tumores malignos e leucemias podem ser propagadas indefinidamente. Uma alteração semelhante pode também ocorrer em células cultivadas, que assim se tornam imortalizadas e tipicamente perdem também algumas características que são características do seu tecido de origem. Esta transformação pode ser induzida, por exemplo, ao infectar as células com o vírus SV40 acima mencionado. Da mesma forma, as células podem ser transformadas por transfecção com um plasmídeo derivado do SV40 que retém as partes cruciais do genoma viral, incluindo o gene que codifica o grande antígeno T. Por outro lado, se o grande antigénio T estiver ausente do plasmídeo, a transformação não ocorre tipicamente[30]. No entanto, foram relatadas algumas excepções[37,38]. Estes casos devem ter surgido devido à perturbação ou desregulamentação dos genes celulares envolvidos no controlo da proliferação.
4.3.3 Integração genómica nas células da linha germinal
Os oócitos podem ser transfectados em vivo em certas fases de maturação[39], tal como as células produtoras de esperma dentro dos testículos[40]. Neste último caso, a prole de animais submetidos a tal tratamento demonstrou ser transgénica. Não se pode, portanto, excluir que as pessoas injectadas com vacinas de mRNA que também contenham ADN dêem subsequentemente origem a crianças transgénicas. A inserção de ADN em células germinativas pode também interferir com o desenvolvimento intra-uterino precoce e assim induzir abortos espontâneos ou malformações.
4.3.4 Como devemos avaliar o risco de inserção genómica?
É certamente verdade que os plasmídeos bacterianos têm uma menor propensão para a inserção no nosso ADN cromossómico do que os vectores da terapia génica especialmente concebidos para uma integração eficiente. Mas quão grande é exactamente o risco no caso dos plasmídeos contidos nas vacinas do mRNA? A resposta simples é que ninguém sabe. Isto não porque seja desconhecido em princípio, mas porque os estudos experimentais apropriados em animais, e subsequentemente em humanos, não foram feitos; ou se o foram, os resultados foram ocultados ao público, e aparentemente também aos reguladores.
Como seriam avaliados tais riscos em procedimentos de aprovação devidamente conduzidos? As actuais orientações da FDA sobre testes e aprovação de terapias genéticas[41] recomendam que, na fase de testes clínicos, os pacientes sejam monitorizados durante 15 anos completos após a administração, com exames anuais durante os cinco anos iniciais. Isto aplica-se aos vectores a que se destina a inserção cromossomática. O documento de orientação procede à construção de uma falsa dicotomia entre os vectores de inserção e não de inserção, mas a linha divisória entre eles permanece indefinida. Por um lado, o documento de orientação sugere que
Os produtos GT [terapia genética] baseados em vectores como os plasmídeos … não são propensos a integrar ou reactivar após a latência, geralmente têm um risco mais baixo de eventos adversos retardados,
mas, por outro lado, afirma que
alterações nos métodos utilizados para introduzir vectores de DNA plasmídeo nas células … resultam em frequências de integração mais elevadas (Ref. 27).
A referência citada nesta última citação é um estudo de Wang et al.[42], que identificaram inequivocamente a inserção de ADN plasmídeo em vivo após injecção intramuscular, que foi seguida de electroporação. Embora a electroporação tenha aumentado a captação celular do ADN injectado em relação à injecção de ADN “nu” apenas, foi provavelmente muito menos eficaz a este respeito do que as nanopartículas lipídicas contidas nas vacinas mRNA. Consequentemente, devemos esperar alguma integração cromossómica do ADN plasmídeo contaminante em vivo.
4.4. Efeito pró-inflamatório do ADN bacteriano
O sistema imunitário inato humano reage com inflamação a várias macromoléculas bacterianas, incluindo o ADN. As grandes quantidades de ADN presentes nas vacinas devem ser consideradas como contribuindo para a inflamação perto do local de injecção, e potencialmente também em qualquer outra parte do corpo.
5. Conclusão
A presença de ADN plasmídeo contaminante nas vacinas mRNA Pfizer e Moderna implica graves riscos para a saúde, para além dos que já eram conhecidos e compreendidos. Estes riscos incluem a expressão prolongada da proteína spike, que pode levar a uma inflamação auto-imune correspondente e mais destrutiva, e a indução de doença maligna após a integração cromossómica do ADN plasmídeo. Além disso, a escala de contaminação prova de forma conclusiva que os fabricantes não dominaram nem implementaram adequadamente os processos de produção concebidos. Cada uma destas questões seria, por si só, razão suficiente para exigir a retirada imediata destas vacinas.
Agradecimentos
Agradecemos a Kevin McKernan e Ulrike Kämmerer pelas correcções e discussão.
Direitos de autor
Este texto está licenciado nos termos da Licença Internacional Creative Commons Attribution 4.0 (CC BY 4.0). Isto significa que é livre de copiar e reutilizar o conteúdo, desde que os autores originais sejam creditados. Se fizer alterações ao texto, deverá indicar explicitamente este facto. Para mais detalhes, consulte o website Creative Commons[43].
Referências
- Andries, O. et al. (2015) N1-methylpseudouridine-incorporated mRNA supera a pseudouridine-{}incorporated mRNA, fornecendo uma melhor expressão proteica e reduzindo a imunogenicidade nas linhas de células de mamíferos e ratos. J. Control.Release 217:337-344
- Anónimo, (2020) Documento de briefing da FDA: Vacina Pfizer-BioNTech COVID-19.
- Anónimo, (2020) Documento de briefing da FDA : MRNA-1273 moderno.
- Anónimo, (2021) relatório de avaliação da EMA: Comirnaty.
- Anónimo, (2021) Relatório de avaliação da EMA: COVID-19 Moderna Vaccine.
- McKernan, K. (2023) O sequenciamento profundo das vacinas bivalentes Moderna e Pfizer identifica a contaminação de vectores de expressão concebidos para amplificação plasmídica em bactérias.
- McKernan, K. (2023) As vacinas bivalentes Pfizer e Moderna contêm 20-35% de vectores de expressão e são competentes na transformação de E. coli.
- McKernan, K. (2023) contaminação por ADN em 8 frascos de vacinas monovalentes Pfizer mRNA.
- Patel, H.K. et al. (2023) Characterization of BNT162b2 mRNA to Evaluate Risk of Off-Target Antigen Translation. J. Pharm.Sci. DOI:10.1016/j.xphs.2023.01.007
- Pardi, N. et al. (2018) Nucleoside-modified mRNA vaccines inducce potent T follicular helper and germinal center B cell responses. J. Exp. Med. 215:1571-1588
- Bansal, S. et al. (2021) Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies: Um Novo Mecanismo de Activação Imune por Vacinas mRNA. J. Immunol. 207:2405-2410
- Castruita, J.A.S. et al. (2023) SRA-CoV-2 seqüências spike de vacina RNA circulam em sangue até 28 dias após a vacinação COVID-19. APMIS 131:128-132
- Fertig, T.E. et al. (2022) O mRNA da vacina pode ser detectado no sangue aos 15 dias pós-vacinação. Biomedicinas 10:1538
- Magen, E. et al. (2022) Clinical and Molecular Characterization of a Rare Case of BNT162b2 mRNA COVID-19 Vaccine-Associated Myositis. Vacinas 10
- Röltgen, K. et al. (2022) Immune imprinting, amplitude de reconhecimento de variantes e resposta do centro germinal na infecção humana por SRA-CoV-2 e vacinação. Cell DOI:10.1016/j.cell.2022.01.018
- Miao, C.H. et al. (2001) Long-term and therapeutic-level hepatic gene expression of human factor IX after naked plasmid transfer in vivo. Mol. Ther. 3:947-57
- Ye, X. et al. (2003) Completa e sustentada correcção fenotípica da hemofilia B em ratos após transferência genética hepática de um plasmídeo de alta expressão do factor humano IX. J. Thromb. Haemost. 1:103-11
- Jager, L. e Ehrhardt, A. (2009) Persistência de vectores adenovirais de alto rendimento como genomas monoméricos de replicação-desfectiva em vitro e no fígado murino. Hum.Gene Ther. 20:883-96
- Li, Y.Q. et al. (2000) [A função do promotor T7 como elementos de acção cis para a polimerase II em células eucarióticas]. Yi Chuan Xue Bao 27:455-61
- Mörz, M. (2022) A Case Report: Necrotizing Encephalitis and Multifocal Myocarditis after BNT162b2 mRNA Vaccination against Covid-19. Vacinas 10:202202060308
- Byrne, B.J. et al. (1983) Definition of the simian virus 40 early promoter region and demonstration of a host range bias in the enhancement effect of the simian virus 40 72-base-pair repeat. Proc.Natl.Acad.Sci.U. S. A. 80:721-5
- Rotondo, J.C. et al. (2019) Association Between Simian Virus 40 and Human Tumors. Front.Oncol. 9:670
- DeCaprio, J.A. e Garcea, R.L. (2013) Uma cornucópia de poliomavírus humanos. Nat.Rev. Microbiol. 11:264-76
- Hussain, I. et al. (2020) Human BK e JC polyomaviruses: percepções moleculares e prevalência na Ásia. Res. Vírus 278:197860
- La Bella, F. e Ozer, H.L. (1985) Differential replication of SV40 and polyoma DNAs in Chinese hamster ovary cells. Res. Virus 2:329-44
- Ehrhardt, A. et al. (2003) Episomal persistence of recombinant adenoviral vector genomes during the cell cycle in vivo. J. Virol. 77:7689-95
- Baltimore, D. (1970) DNA polimerase dependente de RNA em viriões do vírus do tumor de RNA. Natureza 226:1209-11
- Doerfler, W. (2016) Cuidado com as manipulações do genoma: desestabilização epigenética através de inserções de ADN (estrangeiro). Epigenómica 8:587-91
- Doerfler, W. (1996) Um novo conceito em (adenoviral) oncogenesis: integração de DNA estrangeiro e suas consequências. Biochim.Biophys.Acta 1288:F79-99
- Southern, P.J. e Berg, P. (1982) Transformation of mammalian cells to antibiotic resistance with a bacterial gene under control of the SV40 early region promoter. J. Mol. Appl. Genet. 1:327-41
- Stuchbury, G. e Münch, G. (2010) Optimizar a geração de linhas celulares neuronais estáveis através da digestão enzimática de restrição pré-transfecção do ADN plasmídeo. Cytotechnology 62:189-94
- Aldén, M. et al. (2022) Intracellular Reverse Transcription of Pfizer BioNTech COVID-19 mRNA Vaccine BNT162b2 In Vitro in Human Liver Cell Line. Curr.Emite Mol.Biol. 44:1115-1126
- Zhang, L. et al. (2020) SARS-CoV-2 RNA transcrito e integrado no genoma humano. bioRxiv DOI:10.1101/2020.12.12.422516
- Staal, F.J.T. et al. (2008) Sola dosis facit venenum. Leucemia em ensaios de terapia genética: uma questão de vectores, inserções e dosagem? Leucemia 22:1849-1852
- Kohn, D.B. e Gaspar, H.B. (2017) How We Manage Adenosine Deaminase-Deficient Severe Combined Immune Deficiency (ADA SCID). J. Clin. Immunol. -n/d
- Doerfler, W. et al. (2018) Inheritable epigenetic response towards foreign DNA entry by mammalian host cells: a guardian of genomic stability. Epigenética 13:1141-1153
- Sipehia, R. e Martucci, G. (1995) High-efficiency transformation of human endothelial cells by Apo E-mediated transfection with plasmid DNA. Biochem.Biophys.Commun.Res. 214:206-11
- Takahashi, M. et al. (2002) Transformação de células MC3T3-E1 após stress e transfecção com plasmídeo pSV2neo. Res. Anticâncer 22:585-98
- Laurema, A. et al. (2003) Transfection of oocytes and other types of ovarian cells in coelhos after direct injection into uterine arteries of adenoviruses and plasmid/liposomes. Gene Ther. 10:580-4
- Dhup, S. e Majumdar, S.S. (2008) Transgénese através da integração permanente de genes no repovoamento celular espermatogonial in vivo. Nat.Métodos 5:601-3
- Anónimo, (2020) Follow-Up a longo prazo após a administração de produtos de terapia genética humana: Orientação para a Indústria.
- Wang, Z. et al. (2004) Detection of integration of plasmid DNA into host genomic DNA following intramuscular injection and electroporation. Terapia génica. 11:711-21
- Anónimo, (2023) Creative Commons Attribution 4.0 International License (CC BY 4.0).
Originalmente publicado em Doctors for Covid Ethics
Suggest a correction







