I vaccini a mRNA COVID-19 contengono quantità eccessive di DNA batterico: prove e implicazioni
Recenti studi condotti da Kevin McKernan, uno dei maggiori esperti di metodi di sequenziamento del DNA e dell’RNA, hanno rivelato che i lotti di vaccini a mRNA modificato prodotti sia da Pfizer che da Moderna contengono un’elevata percentuale di DNA batterico contaminante. In totale, il DNA rappresenta fino al 20-35% degli acidi nucleici contenuti in ciascuno dei lotti di vaccino. Queste concentrazioni pericolosamente alte superano di gran lunga i livelli considerati sicuri da organizzazioni come l’Agenzia Europea dei Medicinali (EMA). Questo documento riassume le prove di questa contaminazione da DNA e discute i possibili rischi per la salute di chi riceve il vaccino.
1. Il ruolo del DNA nella produzione di vaccini a mRNA
1.1. Contesto generale
La maggior parte dei lettori saprà che
- gli RNA sintetici contenuti nei vaccini a mRNA COVID-19 codificano la proteina SARS-CoV-2 spike;
- nelle cellule viventi dei mammiferi, le istruzioni per costruire una determinata molecola proteica sono memorizzate come un gene all’interno del DNA nel nucleo;
- per costruire una determinata molecola proteica, la cellula trascrive prima il suo gene in RNA e modifica le due estremità di questa molecola per formare l’RNA messaggero (mRNA). L’mRNA viene quindi trasportato dal nucleo al citoplasma, dove induce le fabbriche di proteine della cellula – i ribosomi – a tradurre la sequenza nucleotidica dell’mRNA nella corrispondente sequenza di amminoacidi e ad assemblare la proteina.
1.2. Fasi di produzione di un vaccino a base di mRNA
Poiché la proteina spike è una molecola di grandi dimensioni, lo è anche l’mRNA che la codifica. La sintesi chimica totale di molecole di mRNA di grandi dimensioni non è pratica su scala. Pertanto, per ottenere la molecola di mRNA codificante il picco, viene imitato in vitro il processo con cui le cellule producono i propri mRNA. Ciò comporta le seguenti fasi:
- Una copia del DNA del gene per la proteina spike viene inserita in un plasmide batterico. Si tratta di una molecola di DNA a doppio filamento, a forma di anello, che può esistere in una cellula batterica indipendentemente dal DNA cromosomico della cellula stessa e che può essere copiata e trasmessa ad entrambe le cellule figlie quando la cellula si divide.
- Il plasmide ricombinante (artificiale) che trasporta il gene della proteina spike viene introdotto in una cellula della specie batterica Escherichia coli (E. coli ). Poiché le cellule di E. coli si dividono molto rapidamente, questa singola cellula può, in breve tempo, crescere in un numero molto elevato di cellule. Ognuna di queste cellule progenitrici conterrà le proprie copie ereditate del plasmide e quindi del gene della proteina spike. Sebbene ci sia una certa probabilità che il plasmide venga perso da parte delle cellule figlie durante le successive divisioni cellulari, possiamo imporne il mantenimento dandogli un marcatore selezionabile, che assicura che sopravvivano solo le cellule che conservano il plasmide. Nei plasmidi utilizzati da Pfizer e Moderna, questo marcatore selezionabile è un gene che conferisce alle cellule ospiti la resistenza all’antibiotico kanamicina. Per applicare la selezione, i batteri vengono semplicemente coltivati in presenza di kanamicina.
- Dopo aver fatto crescere un numero sufficiente di cellule batteriche in un brodo nutritivo contenente kanamicina, queste cellule vengono scomposte e il DNA plasmidico viene purificato dagli altri componenti delle cellule batteriche.
- Le molecole plasmidiche a forma di anello vengono convertite in forma lineare utilizzando un enzima di restrizione, che taglia entrambi i filamenti della molecola di DNA in un sito specifico e unico a valle del gene della proteina spike. Questo passaggio è necessario per evitare la formazione di molecole di RNA troppo lunghe che possono avere effetti indesiderati in vivo. Le molecole di DNA linearizzate possono essere purificate dalle molecole circolari rimanenti, ma non è noto al pubblico come e con quale efficienza ciò possa essere fatto nella produzione dei vaccini Pfizer e Moderna.
- Per copiare il gene della proteina spike dalla versione di DNA sul plasmide linearizzato alla versione di mRNA viene utilizzata una RNA polimerasi, in presenza dei necessari mattoncini nucleosidici e cofattori. Sia Pfizer che Moderna utilizzano la RNA polimerasi T7, derivata dall’omonimo batteriofago. Questo enzima si lega a una sequenza promotrice affine, anch’essa derivata dal T7, che è stata costruita nel plasmide a monte del gene per la proteina spike. L’interazione tra la polimerasi e il promotore dà inizio alla trascrizione. In questa fase, il nucleoside sintetico N-metil-pseudouridina (mψU) viene incorporato nell’RNA artificiale al posto del nucleoside naturale uridina. Quando viene somministrato sotto forma di vaccino, l’RNA così modificato risulta meno stimolante per il sistema immunitario innato rispetto all’RNA contenente l’uridina naturale. Inoltre, si traduce più efficacemente in proteine e, in determinate condizioni, è più resistente alla decomposizione [1]. I vaccini a base di mRNA di Pfizer e Moderna contengono mψU al posto dell’uridina.
- Le due estremità di ciascuna molecola di RNA sono accoppiate enzimaticamente a determinate metà che si trovano in queste posizioni anche negli mRNA naturali dei mammiferi e che ne potenziano l’attività biologica e la stabilità in vivo.
Questi passaggi forniscono un mRNA funzionale in grado di istruire i ribosomi delle cellule a produrre la proteina spike. Tuttavia, in questa fase, il prodotto non è ancora puro: è ancora presente tutto il DNA modello di origine batterica. Quest’ultimo non dovrebbe essere incluso nel prodotto farmaceutico finale, perché comporta rischi per la salute dei destinatari (vedi sezione 4). Per eliminare questo DNA, viene aggiunto un altro enzima, la DNasi. Questo dovrebbe scomporre il DNA in frammenti più piccoli, che possono poi essere rimossi dalle molecole di RNA, molto più grandi, mediante filtrazione e altre tecniche di purificazione. Nella fase finale, l’mRNA viene combinato con una miscela di lipidi per essere impacchettato in nanoparticelle lipidiche (LNP), che inducono le cellule umane ad assumere la molecola di mRNA e a produrre la proteina spike.
2. Cosa sapevamo in precedenza del problema della contaminazione del DNA?
In breve, molto poco. I rapporti di valutazione della FDA su entrambi i vaccini[2,3] non menzionano affatto la questione. Il rapporto di valutazione dell’Agenzia Europea per i Medicinali (EMA) sul vaccino Pfizer afferma che “La robustezza della fase di digestione della DNasi non è considerata esaurientemente dimostrata”[4, pag. 17]. Un linguaggio simile è utilizzato nel rapporto dell’EMA sul vaccino Moderna[5, pag. 19f]. Tuttavia, basandosi unicamente su queste scarse informazioni, è impossibile dire se il problema sia stato considerato grave e quali rimedi siano stati eventualmente richiesti dall’ente regolatorio.
3. Prove indipendenti sulla contaminazione da DNA dei prodotti a base di mRNA
Al 3 aprile 2023, Kevin McKernan ha descritto le sue recenti scoperte in tre articoli sul suo sito web Subtack [6-8]. Gli esperimenti descritti nelle prime due relazioni sono stati eseguiti su campioni di vaccino “bivalente” recentemente introdotti da Pfizer e Moderna. Questi preparati assomigliano ai precedenti prodotti “monovalenti” nella loro composizione chimica, cioè dovrebbero contenere mRNA altamente puro, complessato con una miscela di molecole lipidiche (simili a grassi) in nanoparticelle di mRNA/lipidi. L’unica differenza tra le due varietà è che i vaccini bivalenti contengono una miscela di due mRNA che codificano due varianti antigeniche della proteina spike. Questo non ha alcuna rilevanza sul problema tecnico della contaminazione del DNA in quanto tale. Tuttavia, notiamo che l’entità della contaminazione da DNA può variare tra i lotti di produzione e che finora solo un piccolo numero di lotti è stato caratterizzato a questo proposito.
3.1. Il primo rapporto di McKernan
In un primo studio [6], McKernan ha caratterizzato sia l’RNA che il DNA contenuti nei vaccini a base di mRNA.
3.1.1 Estrazione e caratterizzazione diretta degli acidi nucleici del vaccino
Il primo passo è stato quello di rimuovere i lipidi per ottenere gli acidi nucleici puri. Il metodo utilizzato, basato su solventi, non discrimina tra DNA e RNA: se entrambi sono presenti, verranno recuperati entrambi. Gli acidi nucleici estratti sono stati separati in base alle dimensioni. Ciò ha rivelato non solo le specie di mRNA regolari e a picco pieno previste, ma anche frammenti più piccoli, che erano stati precedentemente notati sia dai regolatori sia in un lavoro pubblicato da uno dei produttori [9]. Più sorprendentemente, sono state trovate anche specie di RNA più grandi dell’mRNA completo. Queste specie rimangono non caratterizzate.
3.1.2 Amplificazione degli acidi nucleici estratti
Come fase preparatoria per determinare le esatte sequenze nucleotidiche degli acidi nucleici estratti, questi sono stati amplificati con metodi PCR. Nel caso dell’RNA, la PCR è stata preceduta dalla trascrizione inversa in DNA utilizzando un enzima dedicato (trascrittasi inversa). Poiché lo scopo principale di questo studio era quello di studiare l’RNA e non il DNA, questa fase di amplificazione è stata sbilanciata verso il DNA con l’aggiunta di actinomicina D, che nelle condizioni sperimentali date inibisce selettivamente la sintesi del DNA. Pertanto, nel campione amplificato sono state recuperate quantità relativamente basse di DNA. Tuttavia, nel caso del vaccino Pfizer, la quantità di DNA accertata superava già il limite deciso arbitrariamente dall’EMA per il rapporto massimo consentito tra DNA e RNA.
3.1.3 Risultati del sequenziamento del DNA
Con i prodotti Pfizer e Moderna sono state ottenute sequenze di DNA di plasmidi completi, anche se nel caso dei plasmidi Moderna permangono alcune ambiguità. Le caratteristiche delle sequenze plasmidiche saranno quindi discusse in relazione al secondo studio di McKernan, che ha utilizzato DNA sempre più puro per il sequenziamento e ha quindi fornito risultati più affidabili.
3.2. Il secondo rapporto di McKernan
Il secondo studio [7] si è concentrato sulla quantificazione e sulla caratterizzazione della contaminazione di DNA rilevata qualitativamente nel primo.
3.2.1. Il DNA plasmidico contenuto nei vaccini a base di mRNA ha la capacità di propagarsi nelle cellule batteriche
Nel primo esperimento è stato determinato se il DNA plasmidico, la cui presenza era stata dedotta dai risultati delle sequenze precedenti, è effettivamente biologicamente funzionale, nel senso che può essere introdotto e persistere all’interno di cellule batteriche. A questo scopo, gli acidi nucleici sono stati nuovamente estratti dai campioni di vaccino. Questi acidi nucleici sono stati mescolati con una sospensione di cellule di E. coli rese competenti per l’assorbimento del DNA.
Dopo aver indotto queste cellule ad assumere il DNA e aver dato loro un po’ di tempo per riprendersi, sono state distribuite in capsule Petri riempite con un terreno di crescita solidificato contenente kanamicina. Come già detto, la kanamicina uccide qualsiasi cellula di E. coli che non contenga un gene di resistenza. Pertanto, la crescita osservata di colonie batteriche in queste capsule Petri ha confermato che alcune cellule hanno effettivamente acquisito la resistenza alla kanamicina assorbendo e diffondendo i plasmidi. Ciò è stato osservato sia con i campioni del vaccino Pfizer che con quelli del vaccino Moderna.
In questo contesto, va notato che solo le molecole plasmidiche circolari, ma non quelle linearizzate, possono essere introdotte in modo efficiente nelle cellule batteriche. Il successo di questo esperimento suggerisce quindi che alcune molecole plasmidiche sono sfuggite alla fase di linearizzazione (fase 4 nella sezione 1.2) e hanno completato l’intero processo di produzione nella forma circolare che esiste nelle cellule batteriche. D’altra parte, poiché il numero di colonie batteriche osservate in questo esperimento non era elevato, è probabile che la maggior parte del DNA sia stata effettivamente linearizzata. Poiché i rischi biologici del DNA estraneo all’interno del nostro corpo possono variare a seconda che si tratti di DNA lineare o circolare, la probabile presenza di entrambe le forme nei vaccini è degna di nota. Le esatte proporzioni di DNA circolare e lineare nelle miscele devono ancora essere determinate.
3.2.2 L’abbondanza di DNA contaminante
Il secondo risultato importante di questo studio è la quantificazione mediante PCR del DNA e dell’mRNA contenuti nei campioni di vaccino. Come è noto, in una reazione di PCR, un segmento scelto di una sequenza di acido nucleico viene ridotto mediante sintesi enzimatica in numerosi cicli di reazione successivi. Dal numero di cicli (o duplicazioni) necessari per raggiungere una certa concentrazione soglia, possiamo calcolare quante copie della sequenza target erano presenti all’inizio.
In questi esperimenti, il formato sperimentale scelto è stato la PCR multiplex, cioè due sequenze target sono state amplificate in una singola miscela di reazione. Uno di questi target si trovava all’interno del gene della proteina spike e quindi doveva essere presente sia nelle molecole di DNA plasmidico sia nelle molecole di mRNA spike trascritte da esse. Per includere le molecole di mRNA in questa amplificazione, la PCR è stata nuovamente preceduta dalla trascrizione inversa.
L’altra sequenza target era quella del gene di resistenza alla kanamicina, che dovrebbe essere presente solo nel DNA plasmidico. Confrontando il numero di cicli necessari a ciascuno dei due target per superare la soglia, è stato determinato che fino al 35% dell’acido nucleico totale contenuto nei vaccini è effettivamente DNA. A titolo di confronto, l’EMA ha stabilito che il DNA non deve superare lo 0,033% degli acidi nucleici totali.
3.2.3 Determinazione delle sequenze di DNA plasmidico
I plasmidi originariamente contenuti nei vaccini e poi introdotti in cellule batteriche (vedi sezione 3.2.1) sono stati nuovamente isolati da queste colture batteriche e sono state determinate le loro sequenze complete di DNA. Tali sequenze sono state fornite per intero nel primo studio di McKernan,[6] ma egli ha indicato che stava ancora lavorando per corroborare e perfezionare i dati di sequenziamento. Nel frattempo, le caratteristiche funzionali del DNA plasmidico trovato nei campioni del vaccino Pfizer sono mostrate nella Figura 1. Esse saranno discusse in relazione alla valutazione di rischio.
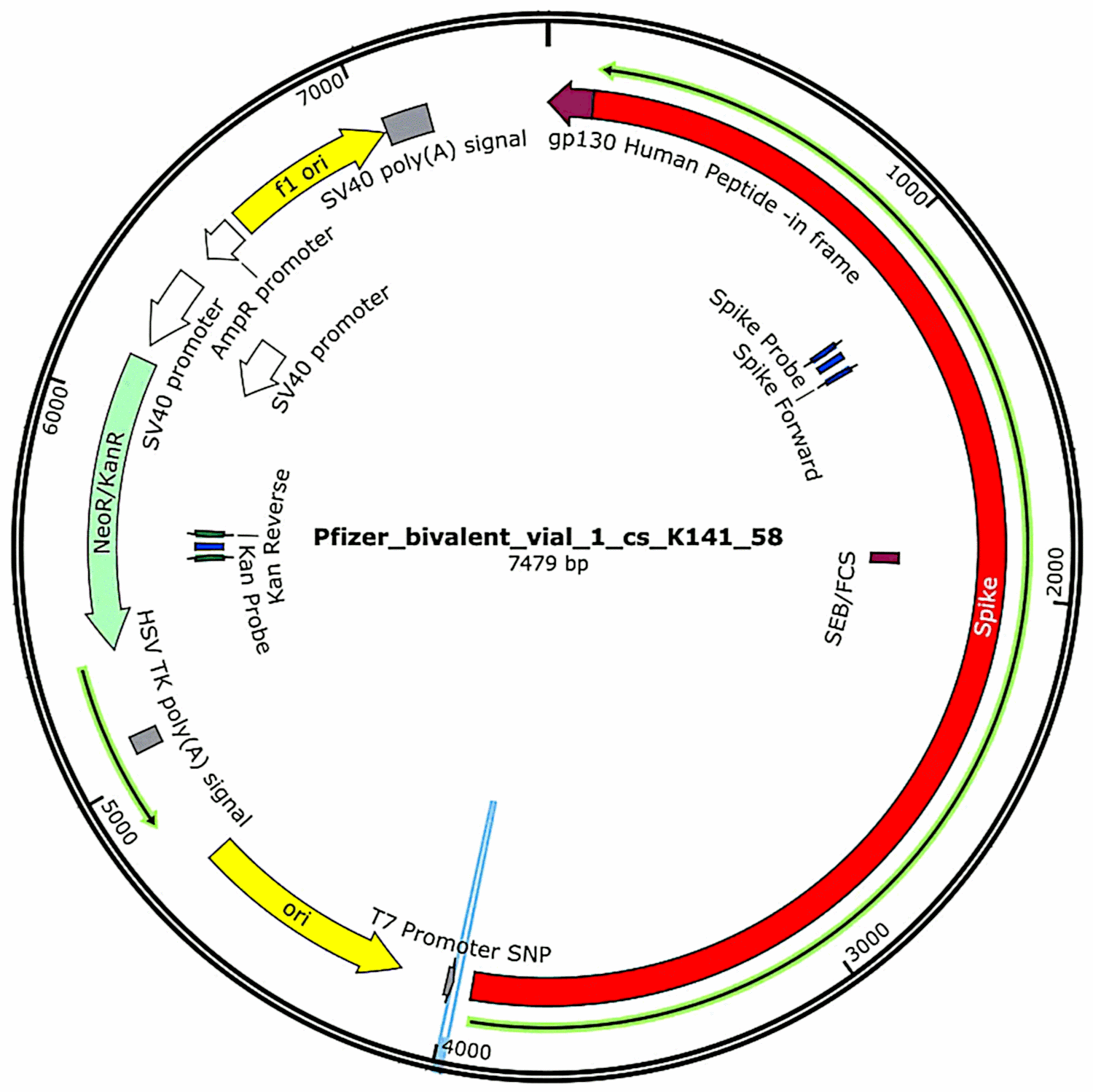
3.3. Il terzo rapporto di McKernan
Nel suo rapporto più recente, McKernan ha esaminato otto fiale di un lotto precedente del vaccino Pfizer utilizzando il metodo della PCR quantitativa descritto sopra. Il contenuto di DNA in questo caso era nettamente inferiore rispetto ai campioni di vaccino bivalente, ma superava comunque il limite MPE di un fattore di 18-70 [8].
4. Valutazione di rischio
Dobbiamo presumere che il DNA ricombinante presente nei vaccini a base di mRNA possa essere introdotto nelle cellule del nostro corpo e che ciò sia favorito dalle nanoparticelle lipidiche, proprio come avviene per l’mRNA stesso. Ciò comporta diversi tipi di rischi per la salute.
4.1. prolungamento della durata dell’espressione della proteina spike
Un argomento chiave che viene regolarmente utilizzato per promuovere la sicurezza percepita del vaccino a mRNA è che l’mRNA ha una vita breve in vivo e che quindi anche l’espressione dell’antigene codificato avrà una vita breve. Ad esempio, il rapporto di valutazione dell’EMA sul vaccino Pfizer afferma in relazione agli esperimenti su animali su un modello di vaccino che erano stati accettati al posto di studi adeguati sul vaccino COVID-19 stesso [4, pag. 46]:
Come previsto per un prodotto a base di mRNA, l’espressione della luciferasi è stata transitoria … Il segnale è diminuito lentamente durante le prime 72 ore e dopo 6 e 9 giorni i segnali erano ulteriormente indeboliti, fino a raggiungere livelli di circa 18 e 7 volte più alti rispetto a quelli ottenuti da animali iniettati con un controllo tampone.
Questi risultati sembrano concordare con due studi in vitro che hanno confrontato la durata dell’espressione proteica tra specie di RNA messaggero identiche nella sequenza, ma contenenti rispettivamente uridina o mψU; come già detto, quest’ultimo è presente anche nei vaccini a base di mRNA di Pfizer e Moderna. In entrambi gli studi [1,10], le specie di RNA modificate con mψU hanno indotto livelli significativamente più elevati di espressione proteica; tuttavia, questa elevata espressione è diminuita con un tempo di dimezzamento simile a quella dell’RNA non modificato. Nessuno dei tempi di dimezzamento desumibili dai dati di entrambi gli studi supera i 4.5 giorni.
Tuttavia, è chiaro da diversi studi su individui vaccinati che sia la proteina spike stessa che gli acidi nucleici che la codificano possono essere rilevati, nel flusso sanguigno e in vari organi, per settimane e persino per mesi dopo l’iniezione [11-15]. Questa discrepanza tra studi in vitro e in vivo è stata finora difficile da comprendere. Gli elevati livelli di DNA plasmidico residuo nei vaccini rilevati da McKernan suggeriscono ora una spiegazione plausibile.
Affinché il DNA plasmidico batterico possa sostenere l’espressione prolungata della proteina spike, devono essere soddisfatte due condizioni:
- il DNA plasmidico deve persistere all’interno delle cellule del nostro corpo e
- il gene della proteina spike in quel plasmide deve essere trascritto in mRNA dalla nostra polimerasi II RNA cellulare.
Sebbene non si disponga ancora di dati sperimentali diretti sui plasmidi di espressione della proteina spike di Pfizer e Moderna, i precedenti suggeriscono che, di fatto, entrambi i requisiti sono soddisfatti. È stato riscontrato che i plasmidi ricombinanti che esprimono il fattore IX della coagulazione persistono nelle cellule epatiche di animali da esperimento a livelli stabili fino a 1,5 anni [16,17] il che corrisponde alla durata totale dell’esperimento. Si potrebbe obiettare che i plasmidi utilizzati in questi studi erano circolari, mentre la maggior parte del DNA plasmidico contenuto nei vaccini a mRNA è probabilmente in forma lineare (si veda la sezione 1.2). In risposta, notiamo che, in primo luogo, è probabile che rimanga del DNA plasmidico circolare (si veda la sezione 3.2.1) e, in secondo luogo, che è stato dimostrato che il DNA virale ricombinante persiste in forma lineare all’interno degli animali per periodi di tempo altrettanto lunghi [18], il che suggerisce che lo stesso potrebbe essere vero per il DNA plasmidico.
Negli studi citati [16,17], il gene che codificava la proteina di interesse (fattore IX) era sotto il controllo di un promotore di mammifero, e in effetti la proteina del fattore IX è stata espressa a livelli stabili per tutto il tempo. Al contrario, il gene della proteina spike contenuto nei plasmidi di espressione Pfizer e Moderna è sotto il controllo di un promotore di batteriofago T7. Non possiamo assumere a priori che questo promotore funzioni in assenza della sua polimerasi RNA T7. Tuttavia, è stato confermato sperimentalmente che il promotore T7 lega anche la polimerasi II RNA cellulare e provoca l’espressione di proteine nelle cellule di mammifero [19].
In sintesi, la possibilità che l’espressione di lunga durata della proteina spike sia causata dal DNA plasmidico contenuto nei vaccini mRNA deve essere presa in seria considerazione. La persistenza prolungata dell’mRNA della proteina spike e la sua espressione dopo la vaccinazione, rilevata in biopsie e autopsie, è stata inequivocabilmente associata a un grave danno [14,20], che è mediato molto probabilmente da un attacco immunitario alle cellule che esprimono questo antigene estraneo. L’omissione di studi sperimentali corrispondenti nella fase di sperimentazione preclinica, insieme alla portata di questa contaminazione, crea un rischio di sicurezza assolutamente inaccettabile.
4.2. rischi associati alle sequenze regolatorie di DNA derivato da SV40
Una caratteristica identificata da McKernan nei plasmidi di Pfizer, ma non in quelli di Moderna [6], è un promotore derivato dal virus SV40, appartenente alla famiglia dei poliomi (vedi sezione 4.2). Questo promotore si trova a monte del gene di resistenza alla kanamicina e, poiché è attivo nelle cellule di mammifero, la proteina codificata da questo gene di resistenza sarà espressa in qualsiasi cellula contenente questo DNA. Come la proteina spike, questa proteina è un antigene estraneo, quindi anch’essa può scatenare un attacco immunitario sulle cellule che la esprimono.
Il promotore SV40 include anche un’origine di riproduzione interna che può potenzialmente causare copie del plasmide all’interno delle cellule di mammifero [21]. Ciò richiede la presenza del grande antigene virale T, una proteina che riconosce direttamente questa origine e avvia la riproduzione della molecola di DNA. Questa proteina non è codificata dal plasmide, né è normalmente presente nelle cellule del nostro corpo, ma può essere fornita dal virus SV40 stesso o da un polyomavirus correlato. Una minoranza della popolazione umana è latentemente infetta da SV40 e questa infezione latente è associata ad alcune malattie maligne e non maligne [22]. Se una copia del plasmide Pfizer viene introdotta in una cellula che ospita l’SV40, è possibile che si formino copie aggiuntive.
Due polyomavirus correlati, molto più diffusi nella popolazione umana, sono il BK e il virus JC [23,24]. Il grande antigene T del JC è apparentemente meno efficace in combinazione con l’origine del SV40 rispetto alla proteina SV40 stessa [25], ma non si può escludere la riproduzione del plasmide Pfizer in cellule latentemente infettate da virus JC o BK. Copie aggiuntive del plasmide così generato amplificherebbero tutti gli altri rischi discussi in questa sezione, con la possibile eccezione dell’infiammazione aspecifica (vedi sezione 4.4).
4.3. Inserimento genomico del DNA plasmidico
Gli scenari discussi finora prevedono tutti la persistenza indipendente ed episodica del DNA plasmidico; esso sarà presente vicino ai cromosomi (all’interno del nucleo della cellula), ma non sarà diventato parte integrante di nessuno di essi. Tali molecole plasmidiche indipendenti e non replicanti tenderanno a perdersi durante la divisione cellulare [26]. Tuttavia, come vedremo, in alcuni casi una molecola plasmidica può essere integrata in uno dei cromosomi della sua cellula ospite e quindi essere ereditata da tutti i discendenti di quella cellula.
L’integrazione cromosomica è una forma di “genotossicità”, cioè di tossicità che causa danni genetici. Per quanto riguarda la possibilità di tali effetti, il rapporto di valutazione dell’EMA sul vaccino a base di mRNA di Pfizer osserva sinteticamente [4, pag. 50]:
Non sono stati forniti studi di genotossicità. Ciò è accettabile in quanto i componenti della formulazione del vaccino sono lipidi e RNA che non dovrebbero avere un potenziale genotossico.
A quanto pare, gli esperti dell’EMA hanno dato per scontato che l’RNA in generale non influisca sull’integrità del genoma della cellula ospite. Questo punto di vista non è corretto e la prima prova che lo dimostra ha recentemente celebrato il suo cinquantesimo anniversario [27]. Tuttavia, l’individuazione di copiose quantità di DNA plasmidico nei vaccini di entrambi i produttori rende superflua l’argomentazione. Sicuramente anche gli scienziati dell’EMA saranno consapevoli che questo DNA può essere integrato nel genoma delle cellule umane ospiti. Non sono richieste specifiche caratteristiche di sequenza perché tale integrazione avvenga e di conseguenza è stata osservata allo stesso modo con il DNA di virus dei mammiferi, batteriofagi e plasmidi [28]. Vale la pena notare che tali inserzioni possono verificarsi in posizioni casuali del genoma, ma i geni che vengono espressi attivamente dalla cellula sono più spesso interessati [29].
L’integrazione cromosomica stabile di un plasmide batterico nel DNA cromosomico di cellule di mammifero è stata dimostrata già nel 1982 [30]. Il plasmide in questione condivide molteplici caratteristiche con quelli utilizzati nella produzione dei vaccini a mRNA di Moderna e Pfizer. L’introduzione di geni estranei o modificati in cellule di mammifero mediante questa e altre tecniche simili è diventata da allora una prassi comune nella ricerca sperimentale e nella biotecnologia. La metodologia viene definita trasfezione e gli organismi così modificati transgeni. Notiamo che l’integrazione stabile può avvenire sia con DNA plasmidico lineare che circolare [31].
In questo contesto, va considerato anche lo studio pubblicato in precedenza da Aldén et al.[32], che ha rilevato copie di DNA del gene della proteina spike in una linea di cellule epatiche umane dopo che queste cellule erano state esposte al vaccino a base di mRNA di Pfizer. Partendo dal presupposto che il vaccino conteneva essenzialmente mRNA puro ma non DNA, hanno considerato questa osservazione come una prova che l’mRNA sintetico aveva subito una trascrizione inversa all’interno di queste cellule. La loro interpretazione è plausibile, perché tale trascrizione inversa è nota in linea di principio ed è stata precedentemente riportata in cellule di pazienti infettati dal virus SARS-CoV-2 [33]. Tuttavia, alla luce della scoperta di McKernan che le fiale di vaccino Pfizer possono contenere quantità sostanziali di DNA, sembra altrettanto possibile che le osservazioni di Aldén et al. indichino semplicemente l’assorbimento cellulare di questo DNA. In ogni caso, i loro risultati indicano la presenza di DNA codificante in queste cellule, il che indica un rischio di inserimento genomico.
4.3.1 Inserimento genomico nella terapia genica con vettori retrovirali
Nella terapia genica vera e propria, spesso si desidera un’integrazione cromosomica che corregga in modo duraturo il difetto genetico in questione. A questo scopo, sono stati sviluppati speciali vettori di DNA che hanno una maggiore propensione a subire tale integrazione. Questi vettori derivano dai retrovirus, la cui strategia di sopravvivenza si basa sull’integrazione genomica. È emerso, tuttavia, che l’integrazione, quando avviene nel punto sbagliato del genoma, spesso induce malattie maligne, in particolare la leucemia [34]. Questo fenomeno è talmente comune che ha impedito l’adozione diffusa della terapia genica, anche in malattie per le quali tutte le altre opzioni terapeutiche sono ugualmente gravate da rischi molto gravi. Un buon esempio è il deficit di adenosina deaminasi, una malattia metabolica che elimina i linfociti, causando così una grave immunodeficienza combinata (SCID), una condizione che senza trattamento è sempre fatale durante l’infanzia. Questa malattia è in linea di principio un obiettivo molto adatto per la terapia genica, ma il trapianto di midollo osseo da un donatore compatibile e imparentato rimane l’opzione terapeutica preferita a causa del grave rischio di tumori maligni indotti dalla terapia genica [35].
4.3.2 In che modo l’inserzione genomica causa i tumori maligni?
Il nostro genoma contiene molteplici geni che possono dare origine al cancro se il loro livello di espressione – la velocità con cui vengono sintetizzate le molecole di mRNA e di proteine – è troppo basso o troppo alto. Può capitare che una molecola di DNA estraneo si inserisca direttamente in un gene di questo tipo e lo metta completamente fuori uso, oppure che si inserisca accanto ad esso e che un forte promotore presente nel DNA estraneo provochi una sovraespressione del gene in questione. Inoltre, è stato osservato che gli eventi di inserzione possono anche causare cambiamenti a livello genomico nella metilazione del DNA, che influenzano i livelli di espressione di molti geni; alcuni di questi cambiamenti possono contribuire all’induzione di malignità. È importante notare che questo effetto è stato osservato non solo nel DNA virale, ma anche nei plasmidi batterici [36].
Quando le cellule vengono isolate da un organo umano o animale sano e coltivate in coltura cellulare, si dividono per un numero limitato di generazioni e poi muoiono. Al contrario, le cellule derivate da tumori maligni e leucemie possono essere propagate indefinitamente. Un cambiamento simile può verificarsi anche nelle cellule coltivate, che diventano così immortali e in genere perdono anche alcune caratteristiche del loro tessuto di origine. Questa trasformazione può essere indotta, ad esempio, infettando le cellule con il già citato virus SV40. Analogamente, le cellule possono essere trasformate mediante trasfezione con un plasmide derivato da SV40 che conserva le parti cruciali del genoma virale, compreso il gene che codifica il grande antigene T. D’altra parte, se il grande antigene T è assente dal plasmide, la trasformazione in genere non avviene [30]. Tuttavia, sono state segnalate alcune eccezioni [37,38]. Questi casi devono essere sorti dall’interruzione o dalla sotto-regolazione di geni cellulari coinvolti nel controllo della proliferazione.
4.3.3 Integrazione genomica nelle cellule germinali
Gli ovociti possono essere trasfettati in vivo in determinati stadi di maturazione [39], così come le cellule spermatiche dei testicoli [40]. In quest’ultimo caso, è stato dimostrato che la prole di animali sottoposti a tale trattamento è transgenica. Non si può quindi escludere che le persone a cui vengono iniettati vaccini a base di mRNA che contengono anche DNA diano successivamente origine a bambini transgenici. L’inserimento di DNA nelle cellule germinali può anche interferire con lo sviluppo intrauterino precoce e quindi indurre aborti spontanei o malformazioni.
4.3.4 Come valutare il rischio di inserimento genomico?
È certamente vero che i plasmidi batterici hanno una minore propensione all’inserimento nel nostro DNA cromosomico rispetto ai vettori di terapia genica appositamente progettati per un’integrazione efficiente. Ma quanto è grande il rischio nel caso dei plasmidi contenuti nei vaccini a base di mRNA? La risposta semplice è che nessuno lo sa. Non perché non sia noto in linea di principio, ma perché non sono stati condotti gli studi sperimentali appropriati sugli animali e successivamente sull’uomo; o se lo sono stati, i risultati sono stati nascosti al pubblico e, a quanto pare, anche alle autorità di regolamentazione.
Come verrebbero valutati tali rischi in procedure di approvazione condotte correttamente? Le attuali linee guida della FDA sulla sperimentazione e l’approvazione delle terapie geniche [41] raccomandano che, nella fase di sperimentazione clinica, i pazienti siano monitorati per 15 anni interi dopo la somministrazione, con esami annuali durante i primi cinque anni. Questo vale per i vettori per i quali è previsto l’inserimento cromosomico. Il documento guida procede a costruire una falsa dicotomia tra vettori di inserzione e vettori non di inserzione, ma la linea di demarcazione tra di essi rimane sfocata. Da un lato, il documento guida suggerisce che
I prodotti GT (terapia genica) basati su vettori quali i plasmidi… non sono proni ad integrare o riattivare dopo la latenza, generalmente hanno un rischio più basso o ritardato di reazioni avverse,
ma, d’altra parte, afferma che
i cambiamenti nei metodi utilizzati per introdurre vettori di DNA plasmidico nelle cellule … comportano una maggiore frequenza di integrazione (Rif. 27).
Il riferimento menzionato in quest’ultima citazione è uno studio di Wang et al. [42], che ha identificato inequivocabilmente l’inserimento di DNA plasmidico in vivo dopo l’iniezione intramuscolare, seguita da elettroporazione. Sebbene l’elettroporazione abbia aumentato l’assorbimento cellulare del DNA iniettato rispetto all’iniezione del solo DNA “nudo”, è stata probabilmente molto meno efficace in questo senso rispetto alle nanoparticelle lipidiche contenute nei vaccini a base di mRNA. Di conseguenza, dovremmo aspettarci una certa integrazione cromosomica del DNA plasmidico contaminante in vivo.
4.4. Effetto pro-infiammatorio del DNA batterico
Il sistema immunitario innato umano reagisce con infiammazione a varie macromolecole batteriche, compreso il DNA. Le grandi quantità di DNA presenti nei vaccini dovrebbero contribuire all’infiammazione in prossimità del sito di iniezione e potenzialmente anche in altre parti del corpo.
5. Conclusione
La presenza di DNA plasmidico contaminante nei vaccini a base di mRNA di Pfizer e Moderna comporta gravi rischi per la salute, oltre a quelli già noti e compresi. Questi rischi includono l’espressione prolungata della proteina spike, che può portare a un’infiammazione autoimmune corrispondente e più distruttiva, e l’induzione di malattie maligne in seguito all’integrazione cromosomica del DNA plasmidico. Inoltre, l’entità della contaminazione dimostra in modo inequivocabile che i produttori non hanno padroneggiato o implementato correttamente i processi produttivi progettati. Ciascuna di queste problematiche sarebbe da sola una ragione sufficiente per richiedere l’immediato ritiro di questi vaccini.
Ringraziamenti
Si ringraziano Kevin McKernan e Ulrike Kämmerer per le correzioni e le discussioni.
Copyright
Questo testo è concesso in licenza secondo i termini della Creative Commons Attribution 4.0 International License (CC BY 4.0). Ciò significa che si è liberi di copiare e riutilizzare il contenuto, a condizione che vengano citati gli autori originali. Se si apportano modifiche al testo, è necessario indicarlo esplicitamente. Per maggiori dettagli, consultare il sito web di Creative Commons [43].
Riferimenti
- Andries, O. et al. (2015) L’mRNA incorporato con N1-metilpseudouridina supera l’mRNA incorporato con pseudouridina, fornendo una maggiore espressione proteica e riducendo l’immunogenicità in linee cellulari di mammifero e di topo. J. Control.Release 217:337-344
- Anonimo, (2020) Documento informativo della FDA: Vaccino COVID-19 di Pfizer-BioNTech.
- Anonimo, (2020) Documento informativo della FDA : MRNA-1273 moderno.
- Anonimo, (2021) Rapporto di valutazione EMA: Comirnaty.
- Anonimo, (2021) Rapporto di valutazione EMA: COVID-19 Moderna Vaccine.
- McKernan, K. (2023) Il sequenziamento profondo dei vaccini bivalenti Moderna e Pfizer identifica la contaminazione dei vettori di espressione progettati per l’amplificazione plasmidica nei batteri.
- McKernan, K. (2023) I vaccini bivalenti Pfizer e Moderna contengono il 20-35% di vettori di espressione e sono competenti per la trasformazione di E.coli.
- McKernan, K. (2023) Contaminazione da DNA in 8 fiale di vaccini monovalenti Pfizer a base di mRNA.
- Patel, H.K. et al. (2023) Caratterizzazione dell’mRNA BNT162b2 per valutare il rischio di traduzione dell’antigene fuori bersaglio. J. Pharm.Sci. DOI:10.1016/j.xphs.2023.01.007
- Pardi, N. et al. (2018) Vaccini a mRNA modificati con nucleosidi inducono potenti risposte delle cellule T helper follicolari e del centro germinale B. J. Exp. Med. 215:1571-1588
- Bansal, S. et al. (2021) Cutting Edge: gli esosomi circolanti con la proteina COVID Spike sono indotti dalla vaccinazione BNT162b2 (Pfizer-BioNTech) prima dello sviluppo di anticorpi: Un nuovo meccanismo di attivazione immunitaria da parte dei vaccini a mRNA. J. Immunol. 207:2405-2410
- Castruita, J.A.S. et al. (2023) Sequenze di spike RNA del vaccino SARS-CoV-2 circolano nel sangue fino a 28 giorni dopo la vaccinazione COVID-19. APMIS 131:128-132
- Fertig, T.E. et al. (2022) L’mRNA del vaccino può essere rilevato nel sangue a 15 giorni dalla vaccinazione. Biomedicina 10:1538
- Magen, E. et al. (2022) Caratterizzazione clinica e molecolare di un raro caso di miosite associata al vaccino BNT162b2 mRNA COVID-19. Vaccini 10
- Röltgen, K. et al. (2022) Imprinting immunitario, ampiezza del riconoscimento delle varianti e risposta del centro germinale nell’infezione e nella vaccinazione contro la SARS-CoV-2 umana. Cell DOI:10.1016/j.cell.2022.01.018
- Miao, C.H. et al. (2001) Espressione genica epatica a lungo termine e a livello terapeutico del fattore IX umano dopo trasferimento di plasmidi nudi in vivo. Mol. Ther. 3:947-57
- Ye, X. et al. (2003) Correzione fenotipica completa e sostenuta dell’emofilia B nei topi dopo il trasferimento genico epatico di un plasmide del fattore IX umano ad alta espressione. J. Thromb. Haemost. 1:103-11
- Jager, L. e Ehrhardt, A. (2009) Persistenza di vettori adenovirali ad alto rendimento come genomi monomerici con difetti di replicazione in vitro e nel fegato murino. Hum.Gene Ther. 20:883-96
- Li, Y.Q. et al. (2000) [La funzione del promotore T7 come elemento cis-acting per la polimerasi II nelle cellule eucariotiche]. Yi Chuan Xue Bao 27:455-61
- Mörz, M. (2022) Un caso clinico: Encefalite necrotizzante e miocardite multifocale dopo la vaccinazione con mRNA BNT162b2 contro Covid-19. Vaccini 10:2022060308
- Byrne, B.J. et al. (1983) Definizione della regione del promotore precoce del simian virus 40 e dimostrazione di una polarizzazione dell’ospite nell’effetto di potenziamento della ripetizione a 72 paia di basi del simian virus 40. Proc.Natl.Acad.Sci.U. S. A. 80:721-5
- Rotondo, J.C. et al. (2019) Associazione tra Simian Virus 40 e tumori umani. Front.Oncol. 9:670
- DeCaprio, J.A. e Garcea, R.L. (2013) Una cornucopia di poliomavirus umani. Nat.Rev. Microbiol. 11:264-76
- Hussain, I. et al. (2020) Human BK and JC polyomavirus: molecular insights and prevalence in Asia. Virus Res. 278:197860
- La Bella, F. e Ozer, H.L. (1985) Replicazione differenziale dei DNA di SV40 e polyoma in cellule ovariche di criceto cinese. Virus Res. 2:329-44
- Ehrhardt, A. et al. (2003) Persistenza episodica di genomi ricombinanti di vettori adenovirali durante il ciclo cellulare in vivo. J. Virol. 77:7689-95
- Baltimore, D. (1970) La DNA polimerasi RNA-dipendente nei virioni di virus tumorali a RNA. Nature 226:1209-11
- Doerfler, W. (2016) Attenzione alle manipolazioni del genoma: destabilizzazione epigenetica tramite inserzioni di DNA (estraneo). Epigenomica 8:587-91
- Doerfler, W. (1996) Un nuovo concetto di oncogenesi (adenovirale): l’integrazione di DNA estraneo e le sue conseguenze. Biochim.Biophys.Acta 1288:F79-99
- Southern, P.J. e Berg, P. (1982) Trasformazione di cellule di mammifero in resistenza agli antibiotici con un gene batterico sotto il controllo del promotore della regione iniziale di SV40. J. Mol. Appl. Genet. 1:327-41
- Stuchbury, G. e Münch, G. (2010) Ottimizzazione della generazione di linee cellulari neuronali stabili mediante digestione dell’enzima di restrizione pre-trasfezione del DNA plasmidico. Citotecnologia 62:189-94
- Aldén, M. et al. (2022) Intracellular Reverse Transcription of Pfizer BioNTech COVID-19 mRNA Vaccine BNT162b2 In Vitro in Human Liver Cell Line. Curr.Emite Mol.Biol. 44:1115-1126
- Zhang, L. et al. (2020) SARS-CoV-2 RNA trascritto e integrato nel genoma umano. bioRxiv DOI:10.1101/2020.12.12.422516
- Staal, F.J.T. et al. (2008) Sola dosis facit venenum. Leucemia negli studi di terapia genica: una questione di vettori, inserti e dosaggio? Leucemia 22:1849-1852
- Kohn, D.B. e Gaspar, H.B. (2017) Come gestiamo l’immunodeficienza combinata grave da deficit di adenosina deaminasi (ADA SCID). J. Clin. Immunol. -n/a
- Doerfler, W. et al. (2018) Risposta epigenetica ereditabile all’ingresso di DNA estraneo da parte delle cellule ospiti dei mammiferi: un guardiano della stabilità genomica. Epigenetica 13:1141-1153
- Sipehia, R. e Martucci, G. (1995) Trasformazione ad alta efficienza di cellule endoteliali umane mediante trasfezione mediata da Apo E con DNA plasmidico. Biochem.Biophys.Commun.Res. 214:206-11
- Takahashi, M. et al. (2002) Trasformazione di cellule MC3T3-E1 dopo stress e trasfezione con il plasmide pSV2neo. Anticancer Res. 22:585-98
- Laurema, A. et al. (2003) Trasfezione di ovociti e altri tipi di cellule ovariche in conigli dopo iniezione diretta nelle arterie uterine di adenovirus e plasmidi/liposomi. Gene Ther. 10:580-4
- Dhup, S. e Majumdar, S.S. (2008) Transgenesi attraverso l’integrazione genica permanente nel ripopolamento delle cellule spermatogoniali in vivo. MetodiNat. 5:601-3
- Anonimo, (2020) Follow-up a lungo termine dopo la somministrazione di prodotti di terapia genica umana: Linee guida per l’industria.
- Wang, Z. et al. (2004) Rilevamento dell’integrazione del DNA plasmidico nel DNA genomico dell’ospite in seguito a iniezione intramuscolare ed elettroporazione. Terapia genica. 11:711-21
- Anonimo, (2023) Licenza Creative Commons Attribuzione 4.0 Internazionale (CC BY 4.0).
Originariamente pubblicato in Medici per l’etica Covid
Suggerisci una correzione







