A COVID-19 mRNS vakcinák túlzott mennyiségű bakteriális DNS-t tartalmaznak: bizonyítékok és következmények
Kevin McKernan, a DNS- és RNS-szekvenálási módszerek vezető szakértője által a közelmúltban végzett vizsgálatok kimutatták, hogy a Pfizer és a Moderna által gyártott módosított mRNS-vakcinák tételei nagy arányban tartalmaznak szennyező bakteriális DNS-t. Összességében a DNS az egyes vakcinatételekben található nukleinsavak 20-35%-át teszi ki. Ezek a riasztóan magas koncentrációk messze meghaladják az olyan szabványügyi szervezetek, mint az Európai Gyógyszerügynökség (EMA) által biztonságosnak tartott szinteket. Ez a dokumentum összefoglalja a DNS-szennyezés bizonyítékait, és megvitatja az oltóanyagot kapókra jelentett lehetséges egészségügyi kockázatokat.
1. A DNS szerepe az mRNS vakcina gyártásában
1.1. Általános háttér
A legtöbb olvasó tisztában lesz azzal, hogy
- a COVID-19 mRNS-vakcinákban található szintetikus RNS-ek a SARS-CoV-2 spike fehérjét kódolják;
- az élő emlőssejtekben egy adott fehérjemolekula felépítésének utasításait génként tárolják a DNS-ben, a sejtmagban;
- egy adott fehérjemolekula felépítéséhez a sejt először átírja a gént RNS-re, és ennek a molekulának a két végét megváltoztatja, hogy hírvivő RNS (mRNS) alakuljon ki. Az mRNS ezután a sejtmagból a citoplazmába kerül, ahol a sejt fehérje-gyárait – a riboszómákat –arra készteti , hogy lefordítsák az mRNS nukleotidszekvenciáját a megfelelő aminosav-szekvenciára, és összeállítsák a fehérjét.
1.2. Az mRNS-vakcina előállításának lépései
Mivel a tüskefehérje nagy molekula, az azt kódoló mRNS is az. A nagy mRNS-molekulák teljes kémiai szintézise nem kivitelezhető méretarányosan. Ezért a csúcsot kódoló mRNS-molekula előállításához laboratóriumban utánozzák azt a folyamatot, amellyel a sejtek saját mRNS-üket termelik. Ez a következő lépéseket foglalja magában:
- A tüskefehérje génjének DNS-másolatát beillesztik egy bakteriális plazmidba. Ez egy olyan gyűrű alakú, kettős szálú DNS-molekula, amely a sejt saját kromoszómális DNS-étől függetlenül képes létezni egy baktériumsejtben, és amely a sejt osztódásakor másolható és átadható mindkét leánysejtnek.
- A spike fehérje génjét hordozó rekombináns (mesterséges) plazmidot az Escherichia coli(E. coli ) baktériumfaj egyik sejtjébe juttatják be. Mivel az E. coli sejtek nagyon gyorsan osztódnak, ez az egyetlen sejt rövid idő alatt nagyon nagy számú sejtté nőhet. Ezen ivadéksejtek mindegyike tartalmazza a plazmid és így a spike fehérje génjének saját öröklött példányait. Bár bizonyos valószínűséggel a plazmid az egymást követő sejtosztódások során az utódok egy részéből elveszik, a fenntartását szelektálható markerrel kényszeríthetjük ki, ami biztosítja, hogy csak azok a sejtek maradjanak életben, amelyek megtartják a plazmidot. A Pfizer és a Moderna által használt plazmidok esetében ez a szelektálható marker egy olyan gén, amely a gazdasejteket a kanamicin antibiotikummal szembeni ellenálló képességgel ruházza fel. A szelekció alkalmazásához a baktériumokat egyszerűen kanamicin jelenlétében kell tenyészteni.
- Miután elegendő számú baktériumsejtet növesztettek kanamicint tartalmazó tápoldatban, ezeket a sejteket lebontják, és a plazmid DNS-t megtisztítják a baktériumsejtek egyéb összetevőitől.
- A gyűrű alakú plazmid molekulákat egy restrikciós enzim segítségével lineáris formába alakítják át, amely a DNS-molekula mindkét szálát egy specifikus, egyedi helyen, a tüskefehérje génje után hasítja. Erre a lépésre azért van szükség, hogy megakadályozzák a túl hosszú RNS-molekulák kialakulását, amelyeknek nemkívánatos hatásai lehetnek élőben. A linearizált DNS-molekulákat meg lehet tisztítani a megmaradó körkörös molekulákból, de hogy ez hogyan és milyen hatékonyan történik a Pfizer és a Modern vakcinák előállítása során, az nem nyilvános.
- Egy RNS-polimeráz segítségével, a szükséges nukleozid építőelemek és kofaktorok jelenlétében, a tüskefehérje génjét a linearizált plazmidon lévő DNS-változatról az mRNS-változatra másolják. A Pfizer és a Moderna is a T7 RNS-polimerázt használja, amely a névadó bakteriofágból származik. Ez az enzim egy rokon, szintén a T7-ből származó promóterszekvenciához kötődik, amelyet a plazmidba a tüskefehérje génje elé építettek be. A polimeráz és a promóter közötti kölcsönhatás indítja el a transzkripciót (átírást). Ebben a szakaszban a szintetikus N-metil-pszeudouridin (mψU) nukleozid épül be a mesterséges RNS-be a természetes uridin nukleozid helyett. Vakcina formájában beadva az így módosított RNS kevésbé stimulálja a veleszületett immunrendszert, mint a természetes uridint tartalmazó RNS. Emellett hatékonyabban alakul át fehérjévé, és bizonyos körülmények között ellenállóbb a lebomlással szemben[1]. A Pfizer és a Moderna mRNS-vakcinái egyaránt mψU-t tartalmaznak uridin helyett.
- Az egyes RNS-molekulák két vége enzimatikusan bizonyos olyan részekhez kapcsolódik, amelyek a természetes emlős mRNS-ekben is megtalálhatóak ezeken a pozíciókban, és amelyek fokozzák biológiai aktivitásukat és stabilitásukat élőben.
Ezek a lépések egy működőképes mRNS-t biztosítanak, amely képes utasítani a sejtek riboszómáit a tüskefehérje előállítására. Ebben a szakaszban azonban a termék még nem tiszta – az összes bakteriális eredetű sablon DNS még mindig jelen van. Ez utóbbi nem kerülhet a végső gyógyszerkészítménybe, mert egészségügyi kockázatot jelent a befogadók számára (lásd a 4. szakaszt). Hogy megszabaduljunk ettől a DNS-től, egy másik, DNáz nevű enzimet adunk hozzá. Ennek kisebb fragmentumokra kell bontania a DNS-t, amelyeket aztán szűréssel és más tisztítási technikákkal el lehet távolítani a sokkal nagyobb RNS-molekulákból. Az utolsó lépésben az mRNS-t egy lipidkeverékkel kombinálják, hogy lipid nanorészecskékbe (LNP-k) csomagolják, amelyek az emberi sejteket arra késztetik, hogy felvegyék az mRNS-molekulát, és létrehozzák a tüskefehérjét.
2. Mit tudtunk korábban a DNS-szennyezés problémájáról?
Röviden, nagyon keveset. Az FDA mindkét vakcináról szóló értékelő jelentése[2,3] egyáltalán nem említi ezt a kérdést. Az Európai Gyógyszerügynökség (EMA) értékelő jelentése a Pfizer vakcináról megemlíti, hogy „A DNáz emésztési lépés robusztusságát nem tekintik alaposan bizonyítottnak”[4, 17. o.]. Hasonló megfogalmazást használ az EMA jelentése a Moderna vakcináról[5, 19f. o.]. Azonban pusztán e kevés információ alapján nem lehet megmondani, hogy a problémát súlyosnak ítélték-e, és hogy a szabályozó hatóság milyen korrekciós intézkedéseket követelt, ha követeltek egyáltalán.
3. Független bizonyítékok az mRNS-termékek DNS-szennyezettségéről
2023. április 3-án Kevin McKernan a Subtack weboldalán[6-8] három cikkben írta le legújabb megállapításait. Az első két jelentésben leírt kísérleteket a Pfizer és a Moderna által nemrégiben bevezetett „kétértékű” vakcinamintákon végezték. Ezek a készítmények kémiai összetételükben hasonlítanak a korábbi „monovalens” készítményekre, azaz nagy tisztaságú mRNS-t kell tartalmazniuk, amely mRNS/lipid nanorészecskékben lipid (zsírszerű) molekulák keverékével komplexálódik. Az egyetlen különbség a két fajta között az, hogy a kétértékű vakcinák a tüskefehérje két antigén változatát kódoló két mRNS keverékét tartalmazzák. Ez nem befolyásolja a DNS-szennyezés technikai problémáját, mint olyat. Megjegyezzük azonban, hogy a DNS-szennyeződés mértéke gyártási tételenként változhat, és hogy eddig csak kevés tételt jellemeztek ebből a szempontból.
3.1. McKernan első jelentése
Egy korai tanulmányában[6] McKernan jellemezte az mRNS-vakcinákban található RNS-t és DNS-t egyaránt.
3.1.1. A vakcinák nukleinsavainak kivonása és közvetlen jellemzése
Az első lépés a lipidek eltávolítása volt a tiszta nukleinsavak kinyerése érdekében. Az alkalmazott oldószeres módszer nem tesz különbséget a DNS és az RNS között – ha mindkettő jelen van, mindkettő kinyerhető. A kivont nukleinsavakat méret szerint választottuk szét. Ez nemcsak a várt szabályos, teljes csúcsú mRNS-fajokat mutatta ki, hanem kisebb fragmentumokat is, amelyeket korábban mind a szabályozók, mind az egyik gyártó által publikált munkában[9] megfigyeltek. Ami még meglepőbb, hogy a teljes hosszúságú mRNS-nél nagyobb RNS-fajokat is találtak. Ezek a fajok továbbra is jellemezetlenek maradtak.
3.1.2 A kivont nukleinsavak amplifikálása
A kivont nukleinsavak pontos nukleotidszekvenciáinak meghatározásához szükséges előkészítő lépésként PCR-módszerrel amplifikáltuk őket. Az RNS esetében a PCR-t megelőzte a DNS-re történő reverz transzkripció egy erre a célra szolgáló enzim (reverz transzkriptáz) segítségével. Mivel e vizsgálat fő célja az RNS és nem a DNS vizsgálata volt, ezt az amplifikációs lépést a DNS ellen irányítottuk actinomycin D hozzáadásával, amely az adott kísérleti körülmények között szelektíven gátolja a DNS-szintézist. Így viszonylag kis mennyiségű DNS-t nyertek vissza az amplifikált mintából. A Pfizer vakcina esetében azonban a megállapított DNS mennyisége már meghaladta az EMA által önkényesen meghatározott, a DNS és az RNS maximálisan megengedett arányára vonatkozó határértéket.
3.1.3. DNS-szekvenálási eredmények
A Pfizer és a Moderna termékek esetében teljes DNS-plazmidok DNS-szekvenciáit kaptuk, bár a Moderna plazmidok esetében maradt némi bizonytalanság. A plazmidszekvenciák jellemzőit ezért McKernan második vizsgálatával kapcsolatban tárgyaljuk, amely egyre tisztább DNS-t használt a szekvenáláshoz, és ezért megbízhatóbb eredményeket szolgáltatott.
3.2. McKernan második jelentése
A második tanulmány[7] az első tanulmányban minőségileg kimutatott DNS-szennyezés számszerűsítésére és jellemzésére összpontosított.
3.2.1. Az mRNS-vakcinákban található plazmid DNS kompetens a baktériumsejtekben való szaporodásra
Az első kísérletben azt határozták meg, hogy az a plazmid DNS, amelynek jelenlétére az előző szekvenciaeredményekből következtettek, valóban biológiailag működőképes-e, azaz bejuttatható-e és fennmaradhat-e a baktériumsejtekben. Ehhez ismét nukleinsavakat vontak ki a vakcinamintákból. Ezeket a nukleinsavakat olyan E. coli sejtek szuszpenziójával keverték össze, amelyeket kompetenssé tettek a DNS felvételére.
Miután ezeket a sejteket a DNS felvételére ösztönöztük, és némi időt adtunk nekik a regenerálódásra, kanamicint tartalmazó megszilárdult táptalajjal töltött Petri-csészékbe terítettük őket. Amint korábban említettük, a kanamicin elpusztít minden olyan E. coli-sejtet, amely nem tartalmaz vele szemben rezisztenciagént. Ezért a baktériumtelepek megfigyelt növekedése ezekben a Petri-csészékben megerősítette, hogy néhány sejt valóban rezisztenciát szerzett a kanamicinnel szemben a plazmidok felvételével és elterjedésével. Ezt mind a Pfizer, mind a Modern vakcinaminták esetében megfigyelték.
Ebben az összefüggésben meg kell jegyeznünk, hogy csak körkörös, de nem linearizált plazmidmolekulákat lehet hatékonyan bejuttatni a baktériumsejtekbe. A kísérlet sikere tehát arra utal, hogy a plazmidmolekulák egy része megúszta a linearizálási lépést (4. lépés az 1.2. szakaszban), és a teljes gyártási folyamaton a baktériumsejtekben létező cirkuláris formában ment keresztül. Másrészt, mivel a kísérletben megfigyelt baktériumtelepek száma nem volt magas, valószínű, hogy a DNS nagy része valóban linearizálódott. Mivel az idegen DNS biológiai veszélyei a saját szervezetünkben eltérőek lehetnek attól függően, hogy lineáris vagy kör alakú, figyelemre méltó, hogy valószínűleg mindkét forma jelen van a vakcinákban. A keverékekben lévő körkörös és lineáris DNS pontos arányát még nem sikerült meghatározni.
3.2.2 A szennyező DNS mennyiségének nagysága
A vizsgálat második fő megállapítása a vakcinamintákban található DNS és mRNS PCR-rel történő számszerűsítése. Mint ismeretes, a PCR-reakcióban a nukleinsav-szekvencia egy kiválasztott szegmensét enzimatikus szintézissel több egymást követő reakciócikluson keresztül redukálják. A bizonyos küszöbkoncentráció eléréséhez szükséges ciklusok (vagy duplikációk) számából kiszámítható, hogy a célszekvencia hány példánya volt jelen a kiinduláskor.
Ezekben a kísérletekben a választott kísérleti formátum multiplex PCR volt, azaz két célszekvenciát amplifikáltunk egyetlen reakcióelegyben. E célszekvenciák egyike a tüske fehérje génjében volt, és így mind a plazmid DNS-molekulákban, mind az azokból átírt spike mRNS-molekulákban jelen kellett lennie. Annak érdekében, hogy az mRNS-molekulákat is bevonjuk ebbe az amplifikációba, a PCR-t ismét reverz transzkripció előzte meg.
A másik célszekvencia a kanamicin-rezisztencia génben volt, amelynek csak a plazmid DNS-ben kell jelen lennie. A két célpont küszöbértékének átlépéséhez szükséges ciklusok számának összehasonlításával megállapították, hogy a vakcinákban található teljes nukleinsav legfeljebb 35%-a valójában DNS. Összehasonlításképpen, az EMA előírta, hogy a DNS nem lehet több, mint az összes nukleinsav 0,033%-a.
3.2.3 A plazmid DNS-szekvenciák meghatározása
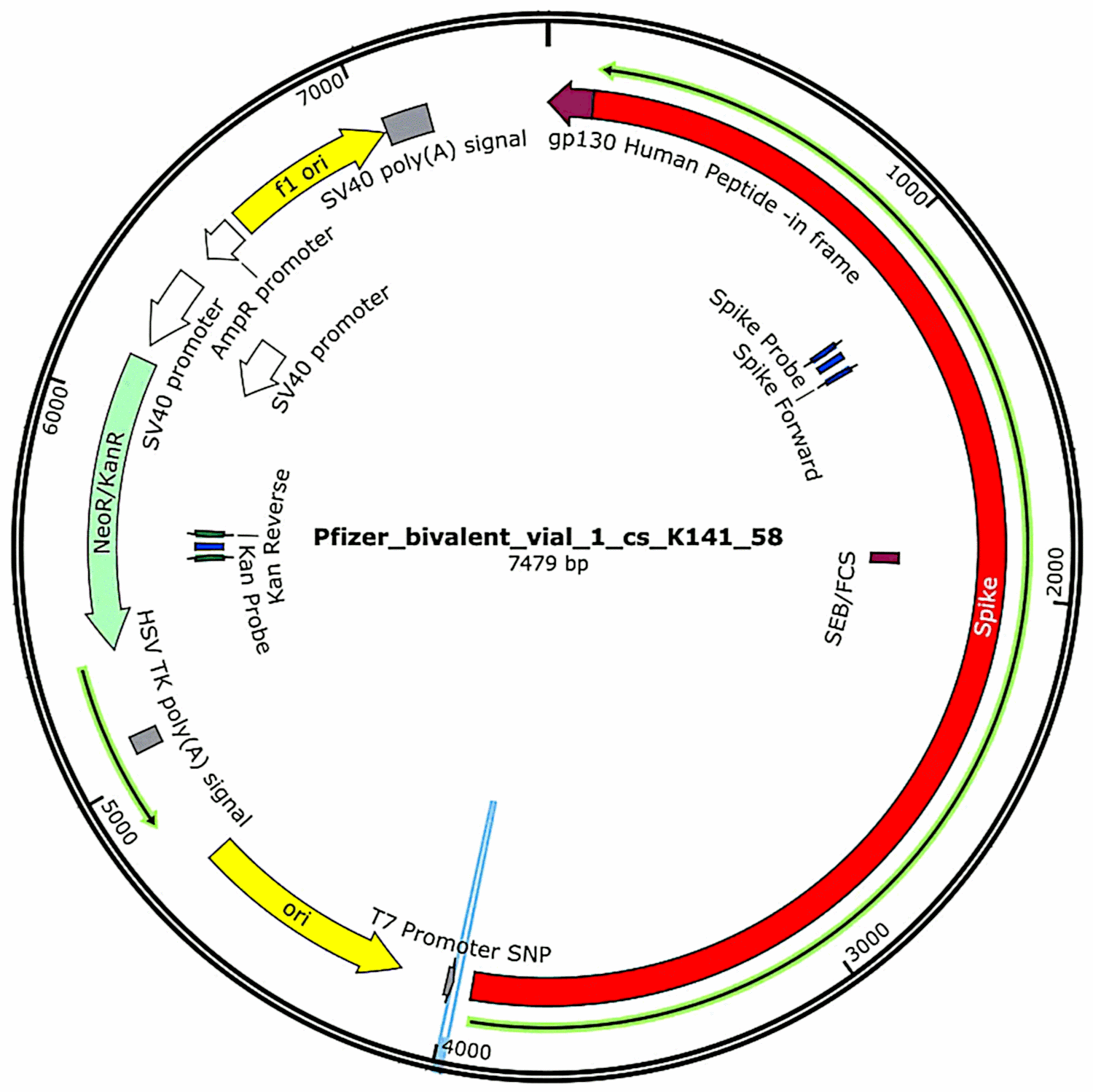
Az eredetileg a vakcinákban lévő, majd baktériumsejtekbe juttatott plazmidokat (lásd a 3.2.1. szakaszt) ismét izolálták ezekből a baktériumtenyészetekből, és meghatározták a teljes DNS-szekvenciájukat. Ezeket a szekvenciákat McKernan első tanulmányában[6] teljes egészében megadta,[7] de jelezte, hogy még mindig dolgozik a szekvenálási adatok megerősítésén és pontosításán. Eközben a Pfizer vakcinamintákban talált plazmid DNS funkcionális jellemzőit az 1. ábra mutatja. Ezeket a kockázatértékelés kapcsán tárgyaljuk.
3.3. McKernan harmadik jelentése
Eddigi legfrissebb jelentésében McKernan a Pfizer vakcinájának egy korábbi tételéből származó nyolc fiolát vizsgált meg a fent leírt kvantitatív PCR-módszerrel. A DNS-tartalom ebben az esetben jelentősen alacsonyabb volt, mint a kétértékű vakcinamintákban, de még így is 18-70-szeresen meghaladta az MPE-határértéket[8].
4. Kockázatértékelés
Feltételeznünk kell, hogy az mRNS vakcinákban található rekombináns DNS bejuthat a szervezetünk sejtjeibe, és ezt a lipid nanorészecskék segítik, csakúgy, mint magának az mRNS-nek a bejuttatását. Ez többféle egészségügyi kockázatot jelent.
4.1. A tüskés fehérje kifejeződésének időtartamának meghosszabbodása
Az mRNS-vakcina vélt biztonságosságát rendszeresen alátámasztó egyik legfontosabb érv, hogy az mRNS az életben rövid élethosszal rendelkezik, és ezért a kódolt antigén kifejeződése is rövid életű lesz. A Pfizer vakcináról szóló EMA értékelő jelentés például a modellvakcinán végzett állatkísérletekkel kapcsolatban megállapítja, hogy azokat a COVID-19 vakcinán végzett megfelelő vizsgálatok helyett fogadták el[4, 46. o.]:
A luciferáz expressziója átmeneti volt, ahogyan az mRNS termék esetében várható volt … A jel lassan csökkent az első 72 óra alatt, majd 6 és 9 nap elteltével a jelek tovább gyengültek, és körülbelül 18- és 7-szer magasabb szintre csökkentek, mint a pufferelt kontrollal befecskendezett állatokból kapott jelek.
Ezek az eredmények egyezni látszanak két élő vizsgálattal, amelyek a fehérje expresszió időtartamát hasonlították össze a szekvenciájukban azonos, de uridint, illetve mψU-t tartalmazó hírvivő RNS-fajok között; mint korábban említettük, ez utóbbi a Pfizer és a Modern mRNS-vakcinákban is jelen van. Mindkét vizsgálatban[1,10] az mψU-val módosított RNS-fajok szignifikánsan magasabb szintű fehérjeexpressziót indukáltak, ez a magas expresszió azonban a nem módosított RNS-hez hasonló felezési idővel csökkent. Egyik vizsgálat adataiból sem lehetett következtetni a 4,5 napot meghaladó felezési időre.
A beoltott egyéneken végzett több vizsgálatból azonban egyértelmű, hogy mind maga a tüskefehérje, mind az azt kódoló nukleinsavak hetekkel, sőt hónapokkal az injekció beadása után is kimutathatók a véráramban és különböző szervekben[11-15]. Ezt az laborban és élőben történő vizsgálatok közötti ellentmondást mindeddig nehéz volt megérteni. A McKernan által kimutatott plazmid DNS-maradványok magas szintje a vakcinákban most egy hihető magyarázatot sugall.
Ahhoz, hogy a bakteriális plazmid DNS támogassa a tüskés fehérje hosszan tartó expresszióját, két feltételnek kell teljesülnie:
- a plazmid DNS-nek meg kell maradnia a testünk sejtjeiben, és
- a plazmidban lévő spike protein gént a saját sejtes RNS-polimeráz II-nek mRNS-é kell átírnia.
Bár még nem rendelkezünk közvetlen kísérleti adatokkal a Pfizer és a Modern spike expressziós plazmidjairól, a precedensek arra utalnak, hogy valójában mindkét feltétel teljesül. A IX-es véralvadási faktort expresszáló rekombináns plazmidokról kiderült, hogy a kísérleti állatok májsejtjeiben akár 1,5 évig is stabilan fennmaradnak,[16,17] ami megfelelt a kísérlet teljes időtartamának. Kifogásolható, hogy az ezekben a vizsgálatokban használt plazmidok cirkulárisak voltak, míg az mRNS-vakcinákban található plazmid DNS nagy része valószínűleg lineáris formában van (lásd az 1.2. szakaszt). Válaszul megjegyezzük, hogy egyrészt valószínűleg marad némi cirkuláris plazmid DNS (lásd a 3.2.1. szakaszt), másrészt pedig, hogy a rekombináns vírusos DNS-ről kimutatták, hogy lineáris formában hasonlóan hosszú ideig megmarad az állatokban[18], ami arra utal, hogy ugyanez igaz lehet a plazmid DNS-re is.
Az idézett vizsgálatokban[16,17] a vizsgált fehérjét (IX-es faktor) kódoló gén emlős promóter irányítása alatt állt, és a IX-es faktor fehérje valóban mindvégig stabil szinten fejeződött ki. Ezzel szemben a Pfizer és a Moderna expressziós plazmidjaiban található spike protein gén T7 bakteriofág promóter irányítása alatt áll. Nem feltételezhetjük eleve, hogy ez a promóter a vele rokon T7 RNS-polimeráz hiányában is működik. Kísérletileg azonban megerősítették, hogy a T7 promóter valójában a sejtes RNS-polimeráz II-t is megköti, és emlőssejtekben fehérje expressziót okoz[19].
Összefoglalva, komolyan kell venni annak lehetőségét, hogy a spike fehérje megfigyelt hosszan tartó expresszióját az mRNS-vakcinákban található plazmid DNS okozza. A spike protein mRNS hosszan tartó perzisztenciája és vakcinázást követő, biopsziákban és boncolásokban kimutatott expressziója egyértelműen súlyos károsodással jár[14,20], amelyet valószínűleg az ezt az idegen antigént expresszáló sejtek elleni immuntámadás közvetít. A preklinikai vizsgálati fázisban a megfelelő kísérleti vizsgálatok elmulasztása, valamint e szennyeződés mértéke teljesen elfogadhatatlan biztonsági kockázatot jelent.
4.2. Az SV40-ből származó szabályozott DNS-szekvenciákkal kapcsolatos kockázatok
Az egyik jellemző, amelyet McKernan azonosított a Pfizer plazmidjaiban, de nem a Moderna expressziós plazmidjaiban[6], egy, a polioma családba tartozó SV40 vírusból származó promóter (lásd a 4.2. szakaszt). Ez a promóter a kanamicin-rezisztencia gén előtt helyezkedik el; és mivel emlőssejtekben aktív, az e rezisztencia gén által kódolt fehérje minden olyan sejtben kifejeződik, amely ezt a DNS-t tartalmazza. A tüskefehérjéhez hasonlóan ez a fehérje is idegen antigén, így ez is kiválthatja az immunrendszer támadását az azt expresszáló sejtek ellen.
Az SV40 promóter egy belső replikációs origót is tartalmaz, amely potenciálisan a plazmid másolatait okozhatja az emlőssejteken belül[21]. Ehhez a nagy vírus T antigén jelenléte szükséges, egy olyan fehérje, amely közvetlenül felismeri ezt az origót, majd elindítja a DNS-molekula replikációját. Ezt a fehérjét nem kódolja a plazmid, és általában nincs is jelen a testünk sejtjeiben, hanem vagy maga az SV40 vírus, vagy egy rokon poliomavírus biztosíthatja. Az emberi populáció egy kisebb része látensen fertőzött az SV40 vírussal, és ez a látens fertőzés összefüggésbe hozható néhány rosszindulatú és nem rosszindulatú betegséggel[22]. Ha a Pfizer-plazmid egy példányát bevisszük egy SV40 vírust hordozó sejtbe, akkor annak további példányai hatékonyan képződhetnek.
Két rokon, az emberi populációban sokkal elterjedtebb poliomavírus a BK- és a JC-vírus[23,24]. A JC nagy T antigén az SV40 eredetű vírussal együtt nyilvánvalóan kevésbé hatékony, mint maga az SV40 fehérje[25], de a Pfizer plazmid szaporodása a JC vagy BK vírusokkal látensen fertőzött sejtekben azonban nem zárható ki. Az ily módon létrehozott plazmid további kópiái felerősítenék az ebben a szakaszban tárgyalt összes többi kockázatot, a nem specifikus gyulladás lehetséges kivételével (lásd a 4.4. szakaszt).
4.3. A plazmid DNS genomiális beillesztése
Az eddig tárgyalt forgatókönyvek mindegyike a plazmid DNS epizodikus, független perzisztenciájával jár; a kromoszómák közelében (a sejtmagban) lesz jelen, de nem válik egyiknek sem szerves részévé. Az ilyen független, nem replikálódó plazmid molekulák a sejtosztódás során általában elvesznek[26]. Azonban, mint látni fogjuk, bizonyos esetekben egy plazmidmolekula valóban beépülhet a gazdasejt egyik kromoszómájába, és aztán az adott sejt összes leszármazottja örökli.
A kromoszómaintegráció a „genotoxicitás” egyik formája, azaz genetikai károsodást okozó toxicitás. Az ilyen hatások lehetőségével kapcsolatban az EMA értékelő jelentése a Pfizer mRNS-vakcináról tömören megjegyzi[4, 50. o.]:
Nem nyújtottak be genotoxicitási vizsgálatokat. Ez elfogadható, mivel a vakcinaformuláció összetevői lipidek és RNS, amelyek várhatóan nem rendelkeznek genotoxikus potenciállal.
Úgy tűnik, az EMA szakértői abból indultak ki, hogy az RNS általában nem befolyásolja a gazdasejt genomjának integritását. Ez a nézet téves, és az ezt bizonyító első bizonyíték nemrég ünnepelte ötvenedik évfordulóját[27]. Azonban a bőséges mennyiségű plazmid DNS kimutatása mindkét gyártó vakcináiban most már szükségtelenné teszi ennek az érvelésnek a szükségességét. Bizonyára még az EMA tudósai is tisztában vannak azzal, hogy ez a DNS beépülhet az emberi gazdasejtek genomjába. Az ilyen integrációhoz nem szükségesek különleges szekvenciajellemzők, és következésképpen ezt ugyanúgy megfigyelték emlősök vírus-DNS-ével, bakteriofágokkal és plazmidokkal[28]. Érdemes megjegyezni, hogy az ilyen beillesztések a genom véletlenszerű helyein is előfordulhatnak, de gyakrabban olyan gének érintettek, amelyeket a sejt aktívan expresszál[29].
Már 1982-ben kimutatták egy bakteriális plazmid stabil kromoszómális integrációját emlőssejtek kromoszómális DNS-ébe[30]. A szóban forgó plazmid több közös tulajdonsággal rendelkezik a Moderna és a Pfizer mRNS-vakcináinak előállításához használt plazmidokkal. Az idegen vagy módosított gének emlőssejtekbe történő bejuttatása ilyen és hasonló technikákkal azóta mindennapossá vált a kísérleti kutatásban és a biotechnológiában. A módszert transzfekciónak, az így módosított szervezeteket pedig transzgéneknek nevezik. Megjegyezzük, hogy a stabil integráció lineáris és cirkuláris plazmid DNS esetén is bekövetkezhet[31].
Ebben az összefüggésben figyelembe kell vennünk Aldén és munkatársai[32] korábban publikált tanulmányát is, akik egy emberi májsejtvonalban a spike protein gén DNS-kópiáit mutatták ki, miután ezeket a sejteket Pfizer mRNS-vakcinának tették ki. Abból a feltételezésből kiindulva, hogy a vakcina lényegében tiszta mRNS-t, de nem DNS-t tartalmazott, ezt a megfigyelést annak bizonyítékaként vették, hogy a szintetikus mRNS reverz transzkripción ment keresztül ezekben a sejtekben. Értelmezésük hihető, mivel az ilyen reverz transzkripció elvileg ismert, és korábban már beszámoltak róla SARS-CoV-2 vírussal fertőzött betegek sejtjeiben[33]. Azonban McKernan felfedezésének fényében, miszerint a Pfizer vakcina fiolák jelentős mennyiségű DNS-t tartalmazhatnak, ugyanilyen lehetségesnek tűnik, hogy az Aldén és munkatársai megfigyelései egyszerűen ennek a DNS-nek a sejtek általi felvételére utalnak. Mindenesetre azonban megállapításaik azt jelzik, hogy ezekben a sejtekben tüskekódoló DNS van jelen, ami a genomiális beillesztés kockázatára utal.
4.3.1 Genomiális inszerció a retrovírus vektorokkal végzett génterápiában
A megfelelő génterápiában gyakran kívánatos a kromoszómális integráció, mivel az tartósan korrigálja a szóban forgó genetikai hibát. Erre a célra speciális DNS-vektorokat fejlesztettek ki, amelyek sokkal nagyobb hajlamot mutatnak az ilyen integrációra. Ezek a vektorok a retrovírusokból származnak, amelyek teljes túlélési stratégiája a genomiális integráción alapul. Kiderült azonban, hogy az integráció, ha a genomon belül rossz helyen történik, gyakran indukál rosszindulatú betegségeket, különösen leukémiát[34]. Ez valójában annyira gyakori, hogy megakadályozta a génterápia széles körű elterjedését, még olyan betegségekben is, amelyek esetében minden más terápiás lehetőség ugyanúgy nagyon komoly kockázatokkal jár. Jó példa erre az adenozin-deamináz-hiány, egy olyan anyagcsere-betegség, amely a limfocitákat eliminálja, és így súlyos kombinált immunhiányt (SCID) okoz, egy olyan állapotot, amely kezelés nélkül gyermekkorban mindig halálos kimenetelű. Ez a betegség elvileg nagyon alkalmas célpont a génterápia számára, de a génterápia által kiváltott rosszindulatú daganatok súlyos kockázata miatt továbbra is a megfelelő és rokon donorból származó csontvelőátültetés az előnyben részesített terápiás lehetőség[35].
4.3.2 Hogyan okoz rosszindulatú daganatokat a genomiális inszerció?
Genomunk számos olyan gént tartalmaz, amelyek rákot okozhatnak, ha expressziós szintjük – az mRNS és a belőlük szintetizálódó fehérjemolekulák szintézisének sebessége – túl alacsony vagy túl magas. Előfordulhat, hogy egy idegen DNS-molekula közvetlenül egy ilyen génbe illeszkedik be, és teljesen kiüti azt, vagy pedig a gén mellé illeszkedik be, és az idegen DNS-ben jelen lévő erős promóter a szóban forgó gén túlkifejeződését okozhatja. Ezenkívül megfigyelték, hogy az inszerciós események a DNS-metilációban genom-szerte változásokat is okozhatnak, ami számos gén expressziós szintjét befolyásolja; és e változások némelyike hozzájárulhat a rosszindulatúság indukciójához. Fontos megjegyezni, hogy ezt a hatást nemcsak vírusos DNS-ben, hanem bakteriális plazmidokban is megfigyelték[36].
Amikor egészséges emberi vagy állati szervből izolálnak sejteket, és sejtkultúrában tenyésztik őket, korlátozott számú generáción keresztül osztódnak, majd elpusztulnak. Ezzel szemben a rosszindulatú daganatokból és leukémiákból származó sejtek korlátlan ideig szaporíthatók. Hasonló változás következhet be a tenyésztett sejtekben is, amelyek így immortalizálódnak, és jellemzően elveszítik a származási szövetükre jellemző egyes tulajdonságokat is. Ez az átalakulás kiváltható például a sejtek fent említett SV40 vírussal való megfertőzésével. Hasonlóképpen, a sejtek átalakíthatók egy SV40-ből származó plazmiddal történő transzfekcióval, amely megtartja a vírusgenom döntő fontosságú részeit, beleértve a nagy T antigént kódoló gént. Másrészt, ha a nagy T antigén hiányzik a plazmidból, a transzformáció jellemzően nem következik be[30]. Néhány kivételről azonban beszámoltak[37,38]. Ezek az esetek a proliferáció szabályozásában szerepet játszó sejtgének megszakításából vagy downregulációjából származhattak.
4.3.3 Genomikus integráció csírasejtekbe
Az oociták az érés bizonyos szakaszaiban élőben transzfektálhatók[39], akárcsak a herékben lévő spermiumtermelő sejtek[40]. Az utóbbi esetben az ilyen kezelésnek alávetett állatok utódai bizonyítottan transzgenikusak. Nem zárható ki tehát, hogy a DNS-t is tartalmazó mRNS-vakcinával beoltott emberekből később transzgénikus gyermekek születnek. A DNS-nek az ivarsejtekbe történő bevitele a korai méhen belüli fejlődést is zavarhatja, és így spontán vetéléseket vagy rendellenességeket idézhet elő.
4.3.4. Hogyan kell értékelnünk a genomikus beillesztés kockázatát?
Bizonyára igaz, hogy a bakteriális plazmidok kevésbé hajlamosak a kromoszómális DNS-ünkbe való beillesztésre, mint a kifejezetten a hatékony integrációra tervezett génterápiás vektorok. De pontosan mekkora a kockázat az mRNS-vakcinákban található plazmidok esetében? Az egyszerű válasz az, hogy senki sem tudja. Ez nem azért van, mert elvileg ismeretlen, hanem azért, mert nem végezték el a megfelelő kísérleti vizsgálatokat állatokon, majd embereken; vagy ha végezték is, az eredményeket elhallgatták a nyilvánosság és nyilvánvalóan a szabályozó hatóságok elől is.
Hogyan értékelnék az ilyen kockázatokat a megfelelően lefolytatott engedélyezési eljárásokban? A génterápiák tesztelésére és jóváhagyására vonatkozó jelenlegi FDA-iránymutatás[41] azt javasolja, hogy a klinikai tesztelési szakaszban a betegeket a beadást követően 15 teljes évig kövessék nyomon, a kezdeti öt év alatt pedig évente vizsgálják meg őket. Ez azokra a vektorokra vonatkozik, amelyekre a kromoszóma-beillesztést tervezik. Az útmutató dokumentum hamis kettősséget állít fel az inszerciós és a nem inszerciós vektorok között, de a köztük húzódó határvonal továbbra is elmosódott. Egyrészt az útmutató dokumentum azt sugallja, hogy
A GT [génterápiás] termékek, amelyek vektorokon, például plazmidokon alapulnak, … nem hajlamosak integrálódni vagy latencia után reaktiválódni, általában kisebb a késleltetett mellékhatások kockázata,
másrészt azonban azt állítja, hogy
a plazmid DNS-vektorok sejtekbe történő bevitelére használt módszerek változásai … magasabb integrációs frekvenciát eredményeznek (27. hivatkozás).
Az utóbbi idézetben hivatkozott hivatkozás Wang és munkatársai[42] tanulmánya, akik egyértelműen azonosították a plazmid DNS élőbeni inszercióját intramuszkuláris injekciót követően, amelyet elektroporáció követett. Bár az elektroporáció megnövelte a beadott DNS sejtes felvételét a „csupasz” DNS kizárólagos beadásához képest, valószínűleg sokkal kevésbé volt hatékony ebből a szempontból, mint az mRNS-vakcinákban található lipid nanorészecskék. Következésképpen a szennyező plazmid DNS bizonyos mértékű kromoszómaintegrációjára kell számítanunk élőben.
4.4. A bakteriális DNS gyulladáskeltő hatása
Az emberi veleszületett immunrendszer gyulladással reagál a különböző bakteriális makromolekulákra, köztük a DNS-re is. A vakcinákban található nagy mennyiségű DNS-ről úgy kell tekinteni, hogy hozzájárul a gyulladáshoz az injekció beadásának helye közelében, és potenciálisan a szervezet más részein is.
5. Következtetés
A Pfizer és a Moderna mRNS-vakcináiban lévő szennyező plazmid DNS jelenléte a már ismert és megértett kockázatokon túlmenően komoly egészségügyi kockázatokat rejt magában. E kockázatok közé tartozik a tüskefehérje hosszan tartó expressziója, amely megfelelő és destruktívabb autoimmun gyulladáshoz vezethet, valamint a plazmid DNS kromoszómális integrációját követően rosszindulatú betegségek indukálása. Ezenkívül a szennyezés mértéke egyértelműen bizonyítja, hogy a gyártók nem sajátították el vagy nem hajtották végre megfelelően a tervezett gyártási folyamatokat. Ezek a problémák önmagukban is elegendő okot jelentenének arra, hogy megköveteljék ezen vakcinák azonnali visszahívását.
Köszönetnyilvánítás
Köszönjük Kevin McKernan és Ulrike Kämmerer javításait és a vitát.
Szerzői jog
Ez a szöveg a Creative Commons Attribution 4.0 International License (CC BY 4.0) feltételei szerint engedélyezett. Ez azt jelenti, hogy a tartalom szabadon másolható és újrafelhasználható, feltéve, hogy az eredeti szerzők feltüntetésre kerülnek. Ha változtatásokat eszközöl a szövegben, ezt kifejezetten jeleznie kell. További részletekért lásd a Creative Commons weboldalát[43].
Hivatkozások
- Andries, O. et al. (2015) N1-metil-pseudouridin-{}beépített mRNS felülmúlja a pseudouridin-{}beépített mRNS-t, fokozott fehérjeexpressziót biztosít és csökkenti az immunogenitást emlős és egér sejtvonalakban. J. Control.Release 217:337-344
- Anonymus, (2020) FDA tájékoztató dokumentum: Pfizer-BioNTech COVID-19 vakcina.
- Anonymous, (2020) FDA tájékoztató dokumentum : modern MRNA-1273.
- Anonymus, (2021) EMA értékelő jelentés: Comirnaty.
- Anonymous, (2021) EMA assessment report: COVID-19 Moderna vakcina.
- McKernan, K. (2023) Deep sequencing of Moderna and Pfizer bivalent vaccines identifies contamination of expression vectors designed for plasmid amplification in bacteria.
- McKernan, K. (2023) A Pfizer és a Moderna bivalens vakcinák 20-35%-ban tartalmaznak expressziós vektorokat, és kompetensek az E.coli transzformációjára.
- McKernan, K. (2023) DNS-szennyeződés 8 fiola monovalens Pfizer mRNS-vakcinában.
- Patel, H.K. et al. (2023) A BNT162b2 mRNS jellemzése a célon kívüli antigén-transzláció kockázatának értékelésére. J. Pharm.Sci. DOI:10.1016/j.xphs.2023.01.007
- Pardi, N. et al. (2018) Nucleoside-modified mRNS vaccines induce potent T follicular helper and germinal center B cell responses. J. Exp. Med. 215:1571-1588
- Bansal, S. et al. (2021) Cutting Edge: COVID Spike fehérjét tartalmazó keringő exoszómákat indukál a BNT162b2 (Pfizer-BioNTech) vakcinázás az antitestek kifejlődése előtt: Az mRNS-vakcinák által történő immunaktiválás új mechanizmusa. J. Immunol. 207:2405-2410
- Castruita, J.A.S. et al. (2023) SARS-CoV-2 tüskés RNS vakcinaszekvenciák a vérben keringenek akár 28 nappal a COVID-19 vakcinázás után. APMIS 131:128-132
- Fertig, T.E. és mtsai. (2022) Az oltóanyag mRNS-e már 15 nappal az oltás után kimutatható a vérben. Biomedicines 10:1538
- Magen, E. et al. (2022) A BNT162b2 mRNS COVID-19 vakcinával összefüggő ritka myositis klinikai és molekuláris jellemzése. Vaccines 10
- Röltgen, K. et al. (2022) Immune imprinting, a variánsfelismerés amplitúdója és a csíraközponti válasz humán SARS-CoV-2 fertőzésben és vakcinációban. Cell DOI:10.1016/j.cell.2022.01.018
- Miao, C.H. et al. (2001) A humán IX-es faktor hosszú távú és terápiás szintű hepatikus génexpressziója meztelen plazmidtranszfert követően in vivo. Mol. Ther. 3:947-57
- Ye, X. és mtsai. (2003) A hemofília B teljes és tartós fenotípusos korrekciója egerekben egy magas expressziós humán IX-es faktor plazmid hepatikus géntranszferjét követően. J. Thromb. Haemost. 1:103-11
- Jager, L. és Ehrhardt, A. (2009) A nagy áteresztőképességű adenovírus vektorok monomer replikáció-defektív genomként való perzisztenciája in vitro és egérmájban. Hum.Gene Ther. 20:883-96
- Li, Y.Q. et al. (2000) [A T7 promóter mint cisz-hatású elem funkciója a polimeráz II számára eukarióta sejtekben]. Yi Chuan Xue Bao 27:455-61
- Mörz, M. (2022) Egy esetről szóló beszámoló: Nekrotizáló agyvelőgyulladás és multifokális szívizomgyulladás a BNT162b2 mRNS elleni Covid-19 elleni oltást követően. Vaccines 10:2022060308
- Byrne, B.J. et al. (1983) A simian virus 40 korai promóter régiójának meghatározása és egy gazdatartománybeli torzítás kimutatása a simian virus 40 72 bázispáros ismétlődésének fokozó hatásában. Proc.Natl.Acad.Sci.U. S. A. 80:721-5
- Rotondo, J.C. et al. (2019) A Simian Virus 40 és az emberi daganatok közötti kapcsolat. Front.Oncol. 9:670
- DeCaprio, J.A. és Garcea, R.L. (2013) A cornucopia of human polyomaviruses. Nat.Rev. Microbiol. 11:264-76
- Hussain, I. et al. (2020) Human BK és JC polyomaviruses: molecular insights and prevalence in Asia. Virus Res. 278:197860
- La Bella, F. és Ozer, H.L. (1985) SV40 és polyoma DNS-ek differenciális replikációja kínai hörcsög petefészek sejtekben. Virus Res. 2:329-44
- Ehrhardt, A. et al. (2003) Rekombináns adenovírus vektor genomok epizomális perzisztenciája a sejtciklus során in vivo. J. Virol. 77:7689-95
- Baltimore, D. (1970) RNS-függő DNS-polimeráz az RNS-tumorvírus virionokban. Nature 226:1209-11
- Doerfler, W. (2016) Óvakodj a genom manipulációktól: epigenetikus destabilizáció (idegen) DNS inszerciók révén. Epigenomics 8:587-91
- Doerfler, W. (1996) Egy új koncepció az (adenovírusos) onkogenezisben: idegen DNS integráció és annak következményei. Biochim.Biophys.Acta 1288:F79-99
- Southern, P.J. és Berg, P. (1982) Emlős sejtek transzformációja antibiotikum-rezisztenciára egy baktérium génnel az SV40 korai régió promóterének irányítása alatt. J. Mol. Appl. Genet. 1:327-41
- Stuchbury, G. és Münch, G. (2010) Stabil neuronális sejtvonalak előállításának optimalizálása a plazmid DNS pre-transzfekciós restrikciós enzim általi emésztésével. Cytotechnology 62:189-94
- Aldén, M. és mtsai. (2022) A Pfizer BioNTech COVID-19 mRNS-vakcina BNT162b2 intracelluláris reverz transzkripciója in vitro emberi májsejtvonalban. Curr.Emite Mol.Biol. 44:1115-1126
- Zhang, L. et al. (2020) SARS-CoV-2 RNS átíródott és integrálódott a humán genomba. bioRxiv DOI:10.1101/2020.12.12.12.422516
- Staal, F.J.T. et al. (2008) Sola dosis facit venenum. Leukémia a génterápiás vizsgálatokban: vektorok, inzertek és adagolás kérdése? Leukémia 22:1849-1852
- Kohn, D.B. és Gaspar, H.B. (2017) Hogyan kezeljük az adenozin-deamináz-hiányos súlyos kombinált immunhiányt (ADA SCID). J. Clin. Immunol. -n/a
- Doerfler, W. et al. (2018) Inheritable epigenetic response towards foreign DNA entry by mammalian host cells: a genomikus stabilitás őre. Epigenetika 13:1141-1153
- Sipehia, R. és Martucci, G. (1995) Humán endotélsejtek nagy hatékonyságú transzformációja Apo E-mediált transzfekcióval plazmid DNS-sel. Biochem.Biophys.Commun.Res. 214:206-11
- Takahashi, M. et al. (2002) MC3T3-E1 sejtek transzformációja stressz és pSV2neo plazmiddal történő transzfekció után. Anticancer Res. 22:585-98
- Laurema, A. et al. (2003) Oociták és más típusú petefészek sejtek transzfekciója nyulakban adenovírusok és plazmid/liposzómák méhartériákba történő közvetlen injektálása után. Gene Ther. 10:580-4
- Dhup, S. és Majumdar, S.S. (2008) Transzgenezis permanens génintegráción keresztül spermatogonális sejtek in vivo újratelepítésében. Nat.Methods 5:601-3
- Anonymus, (2020) Hosszú távú nyomon követés humán génterápiás termékek beadása után: Guidance for Industry (Útmutató az ipar számára).
- Wang, Z. et al. (2004) A plazmid DNS integrációjának kimutatása a gazdaszervezet genomi DNS-ébe intramuszkuláris injekciót és elektroporációt követően. Gene Therapy. 11:711-21
- Anonymous, (2023) Creative Commons Attribution 4.0 International License (CC BY 4.0).
Eredetileg a Doctors for Covid Ethics című folyóiratban jelent meg
Suggest a correction







