Vaccinurile cu ARNm COVID-19 conțin cantități excesive de ADN bacterian: dovezi și implicații
Studii recente efectuate de Kevin McKernan, un expert de frunte în metode de secvențiere a ADN și ARN, au arătat că loturile de vaccinuri cu ARNm modificat produse atât de Pfizer, cât și de Moderna conțin o proporție mare de ADN bacterian contaminant. În total, ADN-ul reprezintă până la 20-35% din acizii nucleici conținuți în fiecare dintre loturile de vaccinuri. Aceste concentrații alarmant de crescute depășesc cu mult nivelurile considerate sigure de către organizațiile de standardizare, cum ar fi Agenția Europeană pentru Medicamente (EMA). Acest document prezintă pe scurt dovezile acestei contaminări cu ADN și discută posibilele riscuri pentru sănătate la care sunt expuși beneficiarii de vaccinuri.
1. Rolul ADN-ului în fabricarea vaccinurilor cu ARNm
1.1. Context general
Majoritatea cititorilor vor fi conștienți de faptul că
- aRN-urile sintetice conținute în vaccinurile cu ARNm COVID-19 codifică proteina spike a SARS-CoV-2;
- în celulele vii de mamifere, instrucțiunile pentru construirea unei anumite molecule de proteină sunt stocate sub forma unei gene în ADN-ul din interiorul nucleului;
- pentru a construi o anumită moleculă proteică, celula transcrie mai întâi gena sa în ARN și modifică cele două vârfuri ale acestei molecule pentru a forma ARN mesager (ARNm). ARNm este apoi transportat din nucleu în citoplasmă, unde induce fabricile celulei de producere de proteine – ribozomii – să traducă secvența de nucleotide din ARNm în secvența de aminoacizi corespunzătoare și să asambleze proteina.
1.2. Etape în fabricarea vaccinului cu ARNm
Deoarece proteina spike este o moleculă mare, la fel este și ARNm care o codifică. Sinteza chimică totală a moleculelor mari de ARNm nu este practică la scară largă. Prin urmare, pentru a obține molecula de ARNm care codifică vârful, procesul prin care celulele își produc propriul ARNm este imitat in vitro. Aceasta implică următoarele etape:
- O copie de ADN a genei pentru proteina spike este inserată într-o plasmidă bacteriană. Aceasta este o moleculă de ADN dublu catenar, în formă de inel, care poate exista într-o celulă bacteriană independent de ADN-ul cromozomial propriu al celulei și care poate fi copiată și transmisă ambelor celule fiice atunci când celula respectivă se divide.
- Plasmida recombinantă (artificială) care poartă gena proteinei spike este introdusă într-o celulă din specia bacteriană Escherichia coli (E. coli ). Deoarece celulele E. coli se divid foarte rapid, această singură celulă poate, într-un timp scurt, să se transforme într-un număr foarte mare de celule. Fiecare dintre aceste celule progenitoare va conține propriile sale copii moștenite ale plasmidei și, prin urmare, ale genei proteinei spike. Deși există o anumită probabilitate ca plasmida să se piardă de la unii dintre descendenți în timpul diviziunilor celulare succesive, putem impune menținerea sa prin adăugarea unui marker selectabil, care asigură supraviețuirea numai a celulelor care păstrează plasmida. În cazul plasmidelor utilizate atât de Pfizer, cât și de Moderna, acest marker selectabil este o genă care conferă celulelor gazdă rezistență la antibioticul kanamicină. Pentru a aplica selecția, bacteriile sunt pur și simplu cultivate în prezența kanamicinei.
- După ce se cultivă un număr suficient de celule bacteriene într-un bulion nutritiv care conține kanamicină, aceste celule sunt descompuse și ADN-ul plasmidic este purificat din celelalte componente ale celulelor bacteriene.
- Moleculele de plasmidă în formă de inel sunt transformate în formă liniară cu ajutorul unei enzime de restricție, care despică ambele șiruri ale moleculei de ADN într-un loc specific, unic, în aval de gena proteinei spike. Această etapă este necesară pentru a preveni formarea unor molecule de ARN prea lungi și care pot avea efecte nedorite in vivo. Moleculele de ADN liniarizate pot fi purificate din moleculele circulare rămase, dar nu se cunoaște public cum și cât de eficient se poate face acest lucru în producția vaccinurilor Pfizer și Moderna.
- Se utilizează o ARN-polimerază, în prezența componentelor nucleozidice și a cofactorilor necesari, pentru a copia gena proteinei spike din versiunea ADN de pe plasmida liniarizată în versiunea ARNm. Atât Pfizer, cât și Moderna utilizează ARN polimerază T7, care provine din bacteriofagul omonim. Această enzimă se leagă de o secvență promotoare înrudită, de asemenea derivată din T7, care a fost proiectată în plasmidă în amonte de gena pentru proteina spike. Această interacțiune între polimerază și promotor inițiază transcrierea. În această etapă, nucleozida sintetică N-metil-pseudouridină (mψU) este încorporată în ARN-ul artificial în locul nucleozidei naturale uridină. Atunci când este administrat sub formă de vaccin, ARN-ul modificat în acest mod stimulează mai puțin sistemul imunitar înnăscut decât ARN-ul care conține uridina naturală. De asemenea, acesta se traduce mai eficient în proteine și, în anumite condiții, este mai rezistent la degradare[1]. Atât vaccinurile cu ARNm de la Pfizer, cât și cele de la Moderna conțin mψU în loc de uridină.
- Cele două vârfuri ale fiecărei molecule de ARN sunt cuplate enzimatic la anumite fracțiuni care se găsesc, de asemenea, în aceste poziții în ARNm natural al mamiferelor și care le sporesc activitatea biologică și stabilitatea in vivo.
Acești pași asigură un ARNm funcțional capabil să dea instrucțiuni ribozomilor celulelor pentru a produce proteina spike. Cu toate acestea, în acest stadiu, produsul nu este încă pur – tot ADN-ul șablon de origine bacteriană este încă prezent. Acesta din urmă nu ar trebui să fie inclus în produsul medicamentos final, deoarece prezintă riscuri pentru sănătatea destinatarilor (a se vedea secțiunea 4). Pentru a scăpa de acest ADN, se adaugă o altă enzimă numită DNază. Aceasta ar trebui să descompună ADN-ul în fragmente mai mici, care pot fi apoi eliminate din moleculele de ARN mult mai mari prin filtrare și alte tehnici de purificare. În etapa finală, ARNm este combinat cu un amestec de lipide pentru a-l împacheta în nanoparticule lipidice (LNP), care induc celulele umane să preia molecula de ARNm și să producă proteina spike.
2. Ce știam anterior despre problema contaminării cu ADN?
Pe scurt, foarte puțin. Rapoartele de evaluare ale FDA privind ambele vaccinuri[2,3] nu menționează deloc această problemă. Raportul de evaluare al Agenției Europene pentru Medicamente (EMA) privind vaccinul Pfizer menționează că „robustețea etapei de digestie cu DNază nu este considerată ca fiind demonstrată în mod temeinic”[4, p. 17]. Un limbaj similar este utilizat în raportul EMA privind vaccinul Moderna[5, p. 19f]. Cu toate acestea, doar pe baza acestor informații limitate, este imposibil de spus dacă problema a fost considerată gravă și ce remedii au fost solicitate de către autoritatea de reglementare, dacă este cazul.
3. Dovezi independente privind contaminarea cu ADN a produselor ARNm
Începând cu 3 aprilie 2023, Kevin McKernan și-a descris descoperirile recente în trei articole de pe site-ul său Subtack[6-8]. Experimentele descrise în primele două rapoarte au fost efectuate pe probe de vaccin „bivalent” recent introduse de Pfizer și Moderna. Aceste preparate se aseamănă cu cele „monovalente” anterioare în ceea ce privește compoziția lor chimică, adică ar trebui să conțină ARNm foarte pur, complexat cu un amestec de molecule lipidice (asemănătoare grăsimilor) în nanoparticule ARNm/lipide. Singura diferență între cele două varietăți este că vaccinurile bivalente conțin un amestec de două ARNm care codifică două variante antigenice ale proteinei spike. Acest lucru nu are nicio legătură cu problema tehnică a contaminării cu ADN ca atare. Cu toate acestea, observăm că gradul de contaminare cu ADN poate varia de la un lot de producție la altul și că, până în prezent, doar un număr mic de loturi au fost caracterizate în această privință.
3.1. Primul raport al lui McKernan
Într-un prim studiu[6], McKernan a caracterizat atât ARN-ul, cât și ADN-ul conținut în vaccinurile cu ARNm.
3.1.1 Extracția și caracterizarea directă a acizilor nucleici din vaccinuri
Primul pas a fost eliminarea lipidelor pentru a obține acizii nucleici puri. Metoda pe bază de solvent utilizată nu face distincție între ADN și ARN – dacă ambele sunt prezente, ambele vor fi recuperate. Acizii nucleici extrași au fost separați în funcție de dimensiune. Acest lucru a evidențiat nu numai speciile de ARNm obișnuite, cu vârfuri complete, ci și fragmente mai mici, care fuseseră observate anterior atât de către autoritățile de reglementare, cât și în lucrările publicate de unul dintre producători[9]. În mod și mai surprinzător, au fost găsite și specii de ARN mai mari decât ARNm de lungime completă. Aceste specii rămân necaracterizate.
3.1.2 Amplificarea acizilor nucleici extrași
Ca etapă pregătitoare pentru a determina secvențele nucleotidice exacte ale acizilor nucleici extrași, aceștia au fost amplificați prin metode PCR. În cazul ARN-ului, PCR a fost precedată de transcrierea inversă în ADN cu ajutorul unei enzime dedicate (transcriptază inversă). Deoarece scopul principal al acestui studiu a fost studierea ARN-ului și nu a ADN-ului, această etapă de amplificare a fost influențată împotriva ADN-ului prin adăugarea de actinomicină D, care, în condițiile experimentale date, inhibă selectiv sinteza ADN-ului. Astfel, în proba amplificată au fost recuperate cantități relativ mici de ADN. Cu toate acestea, în cazul vaccinului Pfizer, cantitatea de ADN determinată ca fiind prezentă a depășit deja limita decisă în mod arbitrar de către EMA pentru raportul maxim admisibil dintre ADN și ARN.
3.1.3 Rezultatele secvențierii ADN
În cazul produselor Pfizer și Moderna, au fost obținute secvențe de ADN ale plasmidelor ADN complete, deși în cazul plasmidelor Moderna au rămas unele ambiguități. Caracteristicile secvențelor plasmidice vor fi, prin urmare, discutate în legătură cu cel de-al doilea studiu al lui McKernan, care a utilizat ADN din ce în ce mai pur pentru secvențiere și, prin urmare, a oferit rezultate mai fiabile.
3.2. Al doilea raport al lui McKernan
Cel de-al doilea studiu[7] s-a concentrat pe cuantificarea și caracterizarea contaminării ADN-ului care a fost detectată calitativ în primul.
3.2.1. ADN-ul plasmidic conținut în vaccinurile cu ARNm este competent să se propage în celulele bacteriene
În primul experiment, s-a determinat dacă ADN-ul plasmidic a cărui prezență a fost dedusă din rezultatele secvenței anterioare este într-adevăr funcțional din punct de vedere biologic, în sensul că poate fi introdus și poate persista în celulele bacteriene. În acest scop, au fost extrași din nou acizi nucleici din probele de vaccin. Acești acizi nucleici au fost amestecați cu o suspensie de celule E. coli care au fost făcute competente pentru absorbția ADN-ului.
După ce aceste celule au fost induse să preia ADN-ul și după ce li s-a acordat un anumit timp pentru a se reface, ele au fost răspândite în plăci Petri umplute cu un mediu de creștere solidificat care conține kanamicină. După cum s-a menționat anterior, kanamicina va ucide orice celulă de E. coli care nu conține o genă de rezistență la aceasta. Prin urmare, creșterea observată a coloniilor bacteriene în aceste vase Petri a confirmat că unele celule au dobândit într-adevăr rezistență la kanamicină prin preluarea și răspândirea plasmidelor. Acest lucru a fost observat atât la probele de vaccin Pfizer, cât și la cele de vaccin Moderna.
În acest context, trebuie să remarcăm că numai moleculele plasmidice circulare, dar nu și cele liniarizate, pot fi introduse eficient în celulele bacteriene. Prin urmare, succesul acestui experiment sugerează că unele dintre moleculele de plasmidă au scăpat de etapa de liniarizare (etapa 4 din secțiunea 1.2) și au parcurs întregul proces de producție în forma circulară care există în celulele bacteriene. Pe de altă parte, deoarece numărul de colonii bacteriene observate în acest experiment nu a fost mare, este probabil ca cea mai mare parte a ADN-ului să fi fost într-adevăr liniarizată. Deoarece pericolele biologice ale ADN-ului străin din propriul nostru organism pot varia în funcție de faptul că acesta este liniar sau circular, prezența probabilă a ambelor forme în vaccinuri este demnă de luat în seamă. Proporțiile exacte de ADN circular și liniar din amestecuri nu au fost încă determinate.
3.2.2 Abundența ADN-ului contaminant
A doua constatare majoră a acestui studiu este cuantificarea prin PCR atât a ADN-ului, cât și a ARNm conținute în probele de vaccin. După cum probabil știți, într-o reacție PCR, un segment ales al unei secvențe de acid nucleic este redus prin sinteză enzimatică pe parcursul mai multor cicluri de reacții succesive. Pornind de la numărul de cicluri (sau de duplicații) necesare pentru a atinge o anumită concentrație de prag, putem calcula câte copii ale secvenței țintă erau prezente la început.
În aceste experimente, formatul experimental ales a fost PCR multiplex, adică două secvențe țintă au fost amplificate într-un singur amestec de reacție. Una dintre aceste ținte se afla în gena proteinei spike și, prin urmare, ar trebui să fie prezentă atât în moleculele de ADN plasmidic, cât și în moleculele de ARNm spike transcrise din acestea. Pentru a include moleculele de ARNm în această amplificare, PCR a fost din nou precedată de transcrierea inversă.
Cealaltă secvență-țintă a fost în cadrul genei de rezistență la kanamicină, care ar trebui să fie prezentă numai în ADN-ul plasmidic. Prin compararea numărului de cicluri necesare pentru ca fiecare dintre cele două ținte să treacă pragul, s-a stabilit că până la 35% din acidul nucleic total conținut în vaccinuri este de fapt ADN. Pentru comparație, EMA a stipulat că ADN-ul nu ar trebui să fie mai mult de 0,033% din totalul acizilor nucleici.
3.2.3 Determinarea secvențelor de ADN plasmidic
Plasmidele care au fost inițial conținute în vaccinuri și apoi introduse în celule bacteriene (a se vedea secțiunea 3.2.1) au fost din nou izolate din aceste culturi bacteriene, iar secvențele lor complete de ADN au fost determinate. Astfel de secvențe au fost furnizate integral în primul studiu al lui McKernan[6], dar acesta a indicat că încă lucra la coroborarea și rafinarea datelor de secvențiere. Între timp, caracteristicile funcționale ale ADN-ului plasmidic găsit în probele de vaccin Pfizer sunt prezentate în figura 1. Acestea vor fi discutate în legătură cu evaluarea riscurilor.
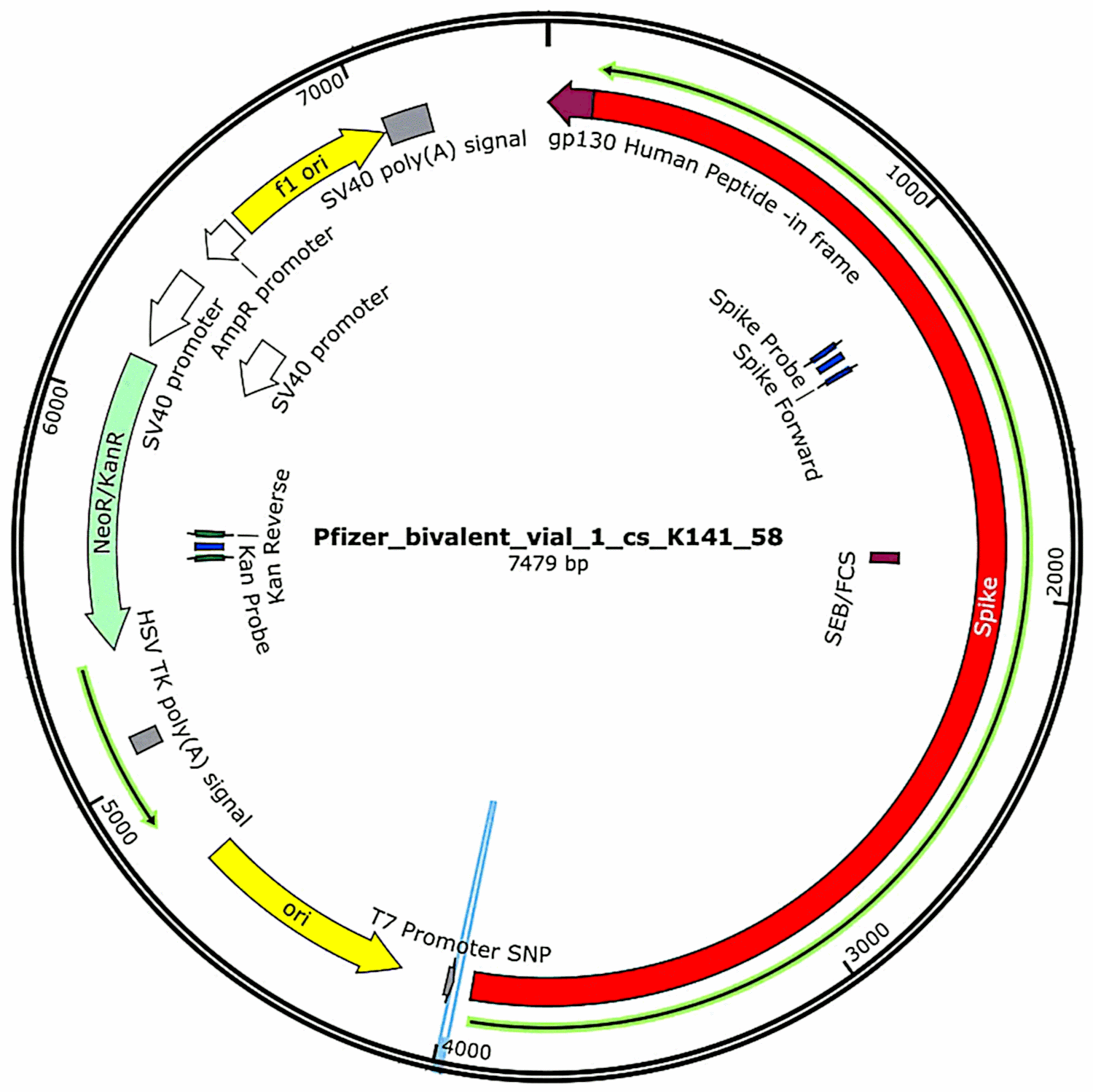
3.3. Al treilea raport al lui McKernan
În cel mai recent raport al său de până acum, McKernan a examinat opt flacoane dintr-un lot anterior al vaccinului Pfizer folosind metoda PCR cantitativă descrisă mai sus. Conținutul de ADN în acest caz a fost net inferior celui din probele de vaccin bivalent, dar a depășit totuși limita MPE cu un factor de 18-70[8].
4. Evaluarea riscurilor
Trebuie să presupunem că ADN-ul recombinant care se găsește în vaccinurile cu ARNm poate fi introdus în celulele corpului nostru și că acest lucru va fi facilitat de nanoparticulele lipidice, la fel ca și în cazul ARNm-ului în sine. Acest lucru prezintă mai multe tipuri diferite de riscuri pentru sănătate.
4.1. prelungirea duratei de exprimare a proteinei spike
Un argument cheie care este utilizat în mod regulat pentru a promova siguranța percepută a vaccinului cu ARNm este că ARNm are o durată de viață scurtă in vivo și că, prin urmare, expresia antigenului codificat va avea și ea o durată de viață scurtă. De exemplu, în raportul de evaluare al EMA privind vaccinul Pfizer se afirmă, în legătură cu experimentele pe animale pe un vaccin model care au fost acceptate în locul unor studii adecvate asupra vaccinului COVID-19 propriu-zis[4, p. 46]:
Așa cum era de așteptat în cazul unui produs ARNm, expresia luciferazei a fost tranzitorie …. Semnalul a scăzut lent în primele 72 de ore, iar după 6 și 9 zile, semnalele au fost în continuare slăbite la niveluri de aproximativ 18 și 7 ori mai mari decât semnalele obținute de la animalele injectate cu control tamponat.
Aceste rezultate par să fie în concordanță cu două studii in vitro care au comparat durata de expresie a proteinelor între speciile de ARN mesager care erau identice ca secvență, dar care conțineau uridină, respectiv mψU; după cum s-a menționat anterior, acesta din urmă este prezent și în vaccinurile cu ARNm Pfizer și Moderna. În ambele studii[1,10], speciile de ARN modificate cu mψU au indus niveluri semnificativ mai ridicate de expresie a proteinelor, însă această expresie ridicată a scăzut cu o durată de înjumătățire similară cu cea a ARN-ului nemodificat. Niciuna dintre duratele de înjumătățire care pot fi deduse din datele din oricare dintre cele două studii nu depășește 4,5 zile.
Cu toate acestea, este clar, din mai multe studii efectuate pe persoane vaccinate, că atât proteina spike în sine, cât și acizii nucleici care o codifică pot fi detectați, în fluxul sanguin și în diferite organe, timp de săptămâni și chiar luni după injectare[11-15]. Această discrepanță între studiile in vitro și cele in vivo a fost până în prezent dificil de înțeles. Nivelurile ridicate de ADN plasmidic rezidual în vaccinurile detectate de McKernan sugerează acum o explicație plauzibilă.
Pentru ca ADN-ul plasmidic bacterian să susțină o expresie prelungită a proteinei spike, trebuie să fie îndeplinite două condiții:
- aDN-ul plasmidic trebuie să persiste în celulele corpului nostru, și
- gena proteinei spike din acea plasmidă trebuie să fie transcrisă în ARNm de către ARN polimeraza II celulară proprie.
Deși nu dispunem încă de date experimentale directe privind plasmidele de expresie a spike-urilor Pfizer și Moderna, cele anterioare sugerează că, de fapt, ambele cerințe sunt îndeplinite. S-a constatat că plasmidele recombinate care exprimă factorul IX de coagulare persistă în celulele hepatice ale animalelor de laborator la niveluri stabile timp de până la 1,5 ani[16,17], ceea ce a corespuns pe durata totală a experimentului. S-ar putea obiecta că plasmidele utilizate în aceste studii erau circulare, în timp ce majoritatea ADN-ului plasmidic conținut în vaccinurile cu ARNm este probabil în formă liniară (a se vedea secțiunea 1.2). Ca răspuns, observăm că, în primul rând, probabil o parte din ADN plasmidic circular rămâne (a se vedea secțiunea 3.2.1) și, că în al doilea rând, s-a demonstrat că ADN-ul viral recombinant persistă în formă liniară în interiorul animalelor pentru perioade de timp la fel de lungi[18], ceea ce sugerează că același lucru poate fi valabil și pentru ADN-ul plasmidic.
În studiile citate[16,17], gena care codifică proteina de interes (factorul IX) a fost sub controlul unui promotor de mamifer și, într-adevăr, proteina factorului IX a fost exprimată la niveluri stabile pe tot parcursul studiului. În schimb, gena proteinei spike conținută în plasmidele de expresie Pfizer și Moderna se află sub controlul unui promotor bacteriofag T7. Nu putem presupune a priori că acest promotor va funcționa în absența ARN-polimerazei T7 pe care o cunoaște. Cu toate acestea, s-a confirmat experimental că, de fapt, promotorul T7 se leagă și de ARN polimeraza II celulară și determină exprimarea proteinei în celulele de mamifere[19].
Pe scurt, posibilitatea ca expresia de lungă durată observată a proteinei spike să fie cauzată de ADN-ul plasmidic conținut în vaccinurile cu ARNm trebuie luată în serios. Persistența prelungită a ARNm al proteinei spike și expresia acesteia după vaccinare, detectată în biopsii și autopsii, a fost asociată fără echivoc cu leziuni grave[14,20], care este cel mai probabil mediată de un atac imunitar asupra celulelor care exprimă acest antigen străin. Omiterea studiilor experimentale corespunzătoare în faza de testare preclinică, împreună cu amploarea acestei contaminări, creează un risc de siguranță total inacceptabil.
4.2. Riscurile asociate secvențelor de ADN reglatoare derivate din SV40
O caracteristică care a fost identificată de McKernan în plasmidele Pfizer, dar nu și în plasmidele de expresie Moderna[6], este un promotor derivat din virusul SV40, care aparține familiei polyoma (a se vedea secțiunea 4.2). Acest promotor este situat în amonte de gena de rezistență la kanamicină; și, deoarece este activ în celulele de mamifere, proteina codificată de această genă de rezistență va fi exprimată în orice celulă care conține acest ADN. La fel ca și proteina spike, această proteină este un antigen străin, astfel încât și ea poate declanșa un atac imunitar asupra celulelor care o exprimă.
Promotorul SV40 include, de asemenea, o origine de replicare internă care poate provoca copii ale plasmidei în celulele de mamifere[21]. Pentru aceasta este necesară prezența antigenului viral mare T, o proteină care recunoaște direct această origine și apoi inițiază replicarea moleculei de ADN. Această proteină nu este codificată de plasmidă și nici nu este prezentă în mod normal în celulele corpului nostru, dar poate fi furnizată fie de virusul SV40 însuși, fie de un virus polyoma înrudit. O minoritate din populația umană este infectată în mod latent cu SV40, iar această infecție latentă este asociată cu unele boli maligne și nemaligne[22]. Dacă o copie a plasmidei Pfizer este introdusă într-o celulă care adăpostește SV40, atunci se pot forma efectiv copii suplimentare ale acesteia.
Două virusuri polyoma înrudite care sunt mult mai răspândite în populația umană sunt virusul BK și virusul JC[23,24]. Antigenul T mare JC este aparent mai puțin eficient în combinație cu originea SV40 decât proteina SV40 în sine[25], dar replicarea plasmidei Pfizer în celulele infectate latent cu virusurile JC sau BK nu poate fi, totuși, exclusă. Copiile suplimentare ale plasmidei generate în acest mod ar amplifica toate celelalte riscuri discutate în această secțiune, cu excepția posibilă a inflamației nespecifice (a se vedea secțiunea 4.4).
4.3. Inserția genomică a ADN-ului plasmidic
Scenariile discutate până acum implică toate persistența independentă episodică a ADN-ului plasmidic; acesta va fi prezent în apropierea cromozomilor (în nucleul celular), dar nu va fi devenit parte integrantă a niciunuia dintre ei. Astfel de molecule de plasmidă independente, care nu se reproduc, vor tinde să se piardă în timpul diviziunii celulare[26]. Cu toate acestea, după cum vom vedea, în unele cazuri, o moleculă de plasmidă poate fi de fapt integrată într-unul dintre cromozomii celulei sale gazdă, iar apoi va fi moștenită de toți descendenții acelei celule.
Integrarea cromozomială este o formă de „genotoxicitate”, adică o toxicitate care provoacă daune genetice. În ceea ce privește posibilitatea unor astfel de efecte, raportul de evaluare EMA privind vaccinul cu ARNm Pfizer notează succint[4, p. 50]:
Nu au fost furnizate studii de genotoxicitate. Acest lucru este acceptabil, deoarece componentele formulării vaccinului sunt lipide și ARN care nu sunt de așteptat să aibă potențial genotoxic.
Aparent, experții EMA au presupus că ARN-ul în general nu va afecta integritatea genomului celulei gazdă. Acest punct de vedere este incorect, iar prima dovadă care a demonstrat acest lucru și-a sărbătorit recent cea de-a cincizecea aniversare[27]. Cu toate acestea, detectarea unor cantități abundente de ADN plasmidic în vaccinurile ambilor producători înlătură acum necesitatea de a susține acest argument. Cu siguranță, chiar și cercetătorii EMA vor fi conștienți de faptul că acest ADN poate fi integrat în genomul celulelor gazdă umane. Nu sunt necesare caracteristici specifice ale secvenței pentru ca o astfel de integrare să aibă loc și, în consecință, aceasta a fost observată în același mod cu ADN-ul virusurilor de mamifere, bacteriofagii și plasmidele[28]. Este demn de remarcat faptul că astfel de inserții pot avea loc în locații aleatorii din genom, dar genele care sunt exprimate în mod activ de către celulă sunt mai des afectate[29].
Integrarea cromozomială stabilă a unei plasmide bacteriene în ADN-ul cromozomal al celulelor de mamifere a fost demonstrată încă din 1982[30]. Plasmida în cauză împărtășește mai multe caracteristici cu cele utilizate în producerea vaccinurilor cu ARNm de la Moderna și Pfizer. Introducerea de gene străine sau modificate în celule de mamifere prin intermediul acestei tehnici și a altor tehnici similare a devenit de atunci un lucru obișnuit în cercetarea experimentală și în biotehnologie. Metodologia este denumită transfecție, iar organismele modificate în acest mod sunt denumite transgene. Menționăm că integrarea stabilă poate avea loc atât cu ADN plasmidic liniar, cât și cu cel circular[31].
În acest context, ar trebui să luăm în considerare și studiul publicat anterior de Aldén et al.[32], care au detectat copii ADN ale genei proteinei spike într-o linie de celule hepatice umane după ce aceste celule au fost expuse la vaccinul cu ARNm Pfizer. Pornind de la ipoteza că vaccinul conținea în esență ARNm pur, dar nu ADN, ei au considerat această observație ca fiind o dovadă că ARNm sintetic a suferit o transcriere inversă în aceste celule. Interpretarea lor este plauzibilă, deoarece se știe că o astfel de transcripție inversă are loc în principiu și a fost raportată anterior în celulele de la pacienții infectați cu virusul SARS-CoV-2[33]. Cu toate acestea, având în vedere descoperirea lui McKernan că fiolele de vaccin Pfizer pot conține cantități substanțiale de ADN, pare la fel de posibil ca observațiile lui Aldén et al. să indice pur și simplu absorbția celulară a acestui ADN. În orice caz, totuși, constatările lor indică prezența ADN-ului codificator de vârfuri în aceste celule, ceea ce indică un risc de inserție genomică.
4.3.1 Inserția genomică în terapia genică cu ajutorul vectorilor retrovirali
În terapia genică propriu-zisă, integrarea cromozomială este deseori dorită, deoarece aceasta va corecta defectul genetic în cauză într-un mod durabil. În acest scop, au fost dezvoltați vectori ADN speciali care au o înclinație mult mai mare de a suferi o astfel de integrare. Acești vectori sunt derivați din retrovirusuri, a căror strategie completă de supraviețuire se bazează pe integrarea genomică. Cu toate acestea, se pare că integrarea, atunci când are loc în locul nepotrivit în cadrul genomului, induce adesea boli maligne, în special leucemie[34]. De fapt, acest lucru este atât de frecvent încât a împiedicat adoptarea pe scară largă a terapiei genice, chiar și în cazul bolilor pentru care toate celelalte opțiuni terapeutice sunt la fel de pline de riscuri foarte grave. Un bun exemplu este deficitul de adenozină deaminază, o boală metabolică care elimină limfocitele, provocând astfel un deficit imunitar combinat sever (DICS), o afecțiune care, fără tratament, este întotdeauna fatală în copilărie. Această boală este, în principiu, o țintă foarte potrivită pentru terapia genică, dar un transplant de măduvă osoasă de la un donator compatibil și înrudit rămâne opțiunea terapeutică preferată din cauza riscului grav de malignități induse de terapia genică[35].
4.3.2 Cum provoacă inserția genomică tumori maligne?
Genomul nostru conține mai multe gene care pot da naștere la cancer dacă nivelul lor de expresie – rata la care sunt sintetizate moleculele de ARNm și proteine din acestea – este prea mică sau prea mare. Se poate întâmpla ca o moleculă de ADN străin să se insereze direct într-o astfel de genă și să o elimine complet, sau se poate insera lângă ea, iar un promotor puternic prezent în acel ADN străin poate determina supraexprimarea genei în cauză. În plus, s-a observat că evenimentele de inserție pot provoca, de asemenea, modificări la nivelul întregului genom în ceea ce privește metilarea ADN-ului, ceea ce va afecta nivelurile de expresie ale multor gene; iar unele dintre aceste modificări pot contribui la inducerea malignității. Este important de remarcat faptul că acest efect a fost observat nu numai în ADN viral, ci și în plasmidele bacteriene[36].
Atunci când celulele sunt izolate dintr-un organ uman sau animal sănătos și cultivate în culturi celulare, acestea se divid pentru un număr limitat de generații și apoi mor. În schimb, celulele derivate din tumori maligne și leucemii pot fi înmulțite la nesfârșit. O schimbare similară poate avea loc și în cazul celulelor cultivate, care devin astfel imortalizate și, de obicei, își pierd și unele caracteristici caracteristice țesutului lor de origine. Această transformare poate fi indusă, de exemplu, prin infectarea celulelor cu virusul SV40 menționat mai sus. În mod similar, celulele pot fi transformate prin transfecția cu o plasmidă derivată din SV40 care păstrează părțile esențiale ale genomului viral, inclusiv gena care codifică antigenul T mare. Pe de altă parte, în cazul în care antigenul T mare este absent din plasmidă, transformarea nu are loc în mod obișnuit[30]. Cu toate acestea, au fost raportate unele excepții[37,38]. Aceste cazuri trebuie să fi apărut în urma întreruperii sau a inhibării genelor celulare implicate în controlul proliferării.
4.3.3. Integrarea genomică în celule germinale
Ovocitele pot fi transfectate in vivo în anumite stadii de maturare[39], la fel ca și celulele producătoare de spermatozoizi din cadrul testiculelor[40]. În acest din urmă caz, s-a demonstrat că descendenții animalelor supuse unui astfel de tratament sunt transgenici. Prin urmare, nu poate fi exclus ca persoanele injectate cu vaccinuri cu ARNm care conțin și ADN să dea naștere ulterior la copii transgenici. Inserția ADN-ului în celulele germinale poate, de asemenea, să interfereze cu dezvoltarea intrauterină timpurie și să inducă astfel avorturi spontane sau malformații.
4.3.4 Cum ar trebui să evaluăm riscul de inserție genomică?
Este cu siguranță adevărat că plasmidele bacteriene au o tendință mai scăzută de inserție în ADN-ul nostru cromozomial decât vectorii de terapie genică special concepuți pentru o integrare eficientă. Dar cât de mare este exact riscul în cazul plasmidelor conținute în vaccinurile cu ARNm? Răspunsul simplu este că nimeni nu știe. Acest lucru nu se datorează faptului că nu este necunoscut în principiu, ci pentru că nu au fost efectuate studii experimentale adecvate pe animale și, ulterior, pe oameni; sau, dacă au fost efectuate, rezultatele au fost ascunse publicului și, aparent, și autorităților.
Cum ar fi evaluate astfel de riscuri în cadrul unor proceduri de aprobare desfășurate în mod corespunzător? Ghidul actual al FDA privind testarea și aprobarea terapiilor genice[41] recomandă ca, în faza de testare clinică, pacienții să fie monitorizați timp de 15 ani întregi după administrare, cu examinări anuale în primii cinci ani. Acest lucru se aplică vectorilor pentru care este destinată inserția cromozomială. Documentul de orientare continuă să construiască o falsă dihotomie între vectorii de inserție și cei de neinserție, dar linia de demarcație dintre aceștia rămâne neclară. Pe de o parte, documentul de orientare sugerează că
Produsele TG [de terapie genică] care se bazează pe vectori precum plasmidele … nu sunt predispuse la integrare sau reactivare după latență, au, în general, un risc mai mic de evenimente adverse întârziate,
dar, pe de altă parte, afirmă că
schimbările în metodele utilizate pentru introducerea vectorilor de ADN plasmidic în celule … au ca rezultat frecvențe de integrare mai mari (Ref. 27).
Referința citată în acest ultim citat este un studiu realizat de Wang et al.[42], care a identificat fără echivoc inserția ADN plasmidic in vivo după injectarea intramusculară, care a fost urmată de electroporare. Deși electroporarea a crescut absorbția celulară a ADN-ului injectat în raport cu injectarea ADN-ului „gol” singur, a fost probabil mult mai puțin eficientă în această privință decât nanoparticulele lipidice conținute în vaccinurile cu ARNm. În consecință, ar trebui să ne așteptăm la o anumită integrare cromozomială a ADN-ului plasmidic contaminant in vivo.
4.4. Efectul proinflamator al ADN-ului bacterian
Sistemul imunitar înnăscut uman reacționează prin inflamație la diverse macromolecule bacteriene, inclusiv la ADN. Cantitățile mari de ADN prezente în vaccinuri ar trebui să fie considerate ca contribuind la inflamarea în apropierea locului de injectare și, potențial, și în alte părți ale corpului.
5. Concluzie
Prezența ADN plasmidic contaminant în vaccinurile cu ARNm ale Pfizer și Moderna implică riscuri grave pentru sănătate, pe lângă cele care erau deja cunoscute și înțelese. Aceste riscuri includ expresia prelungită a proteinei spike, care poate duce la o inflamație autoimună corespunzătoare și mai distructivă, precum și inducerea de boli maligne în urma integrării cromozomiale a ADN-ului plasmidic. În plus, amploarea contaminării dovedește în mod concludent că producătorii nu au stăpânit sau nu au implementat în mod corespunzător procesele de producție proiectate. Fiecare dintre aceste aspecte ar fi un motiv suficient pentru a solicita retragerea imediată a acestor vaccinuri.
Recunoștințe
Le mulțumim lui Kevin McKernan și Ulrike Kämmerer pentru corecții și discuții.
Drepturi de autor
Acest text este licențiat în conformitate cu termenii licenței Creative Commons Attribution 4.0 International License (CC BY 4.0). Acest lucru înseamnă că sunteți liberi să copiați și să reutilizați conținutul, cu condiția ca autorii originali să fie menționați. Dacă aduceți modificări textului, trebuie să indicați explicit acest lucru. Pentru mai multe detalii, consultați site-ul Creative Commons[43].
Referințe
- Andries, O. et al. (2015) ARNm încorporat cu N1-metilpseudouridină depășește ARNm încorporat cu pseudouridină-{}, oferind o expresie îmbunătățită a proteinei și reducând imunogenitatea în liniile celulare de mamifere și de șoareci. J. Control.Release 217:337-344
- Anonim, (2020) Document de informare al FDA: Vaccinul Pfizer-BioNTech COVID-19.
- Anonim, (2020) Document de informare al FDA : MRNA-1273 modern.
- Anonim, (2021) Raport de evaluare EMA: Comirnaty.
- Anonymous, (2021) Raport de evaluare EMA: Vaccinul COVID-19 Moderna.
- McKernan, K. (2023) Secvențierea profundă a vaccinurilor bivalente Moderna și Pfizer identifică contaminarea vectorilor de expresie concepuți pentru amplificarea plasmidelor în bacterii.
- McKernan, K. (2023) Vaccinurile bivalente Pfizer și Moderna conțin 20-35% vectori de expresie și sunt competente la transformarea E.coli.
- McKernan, K. (2023) Contaminare cu ADN în 8 flacoane de vaccinuri monovalente Pfizer cu ARNm.
- Patel, H.K. et al. (2023) Caracterizarea ARNm BNT162b2 pentru a evalua riscul de traducere a antigenului în afara țintei. J. Pharm.Sci. DOI:10.1016/j.xphs.2023.01.007
- Pardi, N. et al. (2018) Vaccinurile ARNm modificate cu nucleozide induc răspunsuri puternice ale celulelor T foliculare ajutătoare și ale celulelor B din centrul germinal. J. Exp. Med. 215:1571-1588
- Bansal, S. et al. (2021) Cutting Edge: Exozomii circulanți cu proteina COVID Spike sunt induși de vaccinarea BNT162b2 (Pfizer-BioNTech) înainte de dezvoltarea anticorpilor: Un mecanism nou de activare imunitară prin vaccinuri cu ARNm. J. Immunol. 207:2405-2410
- Castruita, J.A.S. et al. (2023) Secvențe spike de ARN ale vaccinului SARS-CoV-2 circulate în sânge până la 28 de zile după vaccinarea COVID-19. APMIS 131:128-132
- Fertig, T.E. et al. (2022) ARNm vaccinal poate fi detectat în sânge la 15 zile după vaccinare. Biomedicine 10:1538
- Magen, E. et al. (2022) Caracterizarea clinică și moleculară a unui caz rar de miozită asociată cu vaccinul BNT162b2 mRNA COVID-19 asociat cu vaccinul BNT162b2. Vaccines 10
- Röltgen, K. et al. (2022) Imprintingul imunitar, amplitudinea recunoașterii variantelor și răspunsul centrului germinal în infecția și vaccinarea SARS-CoV-2 la om. Cell DOI:10.1016/j.cell.2022.01.018
- Miao, C.H. et al. (2001) Expresia genetică hepatică pe termen lung și la nivel terapeutic a factorului IX uman după transferul de plasmidă goală in vivo. Mol. Ther. 3:947-57
- Ye, X. et al. (2003) Corecția fenotipică completă și susținută a hemofiliei B la șoareci după transferul genetic hepatic al unei plasmide de factor IX uman de înaltă expresie. J. Thromb. Haemost. 1:103-11
- Jager, L. și Ehrhardt, A. (2009) Persistența vectorilor adenovirali de mare capacitate ca genomuri monomerice cu defecte de replicare in vitro și în ficatul murin. Hum.Gene Ther. 20:883-96
- Li, Y.Q. et al. (2000) [The function of T7 promoter as cis-acting elements for polymerase II in eukaryotic cells]. Yi Chuan Xue Bao 27:455-61
- Mörz, M. (2022) Un raport de caz: Encefalită necrozantă și miocardită multifocală după vaccinarea cu ARNm BNT162b2 împotriva Covid-19. Vaccines 10:2022060308
- Byrne, B.J. et al. (1983) Definirea regiunii promotorului timpuriu al virusului simian 40 și demonstrarea unei distorsiuni a intervalului de gazde în efectul de intensificare a repetiției de 72 de perechi de baze a virusului simian 40. Proc.Natl.Acad.Sci.U. S. A. 80:721-5
- Rotondo, J.C. et al. (2019) Asocierea dintre virusul simian 40 și tumorile umane. Front.Oncol. 9:670
- DeCaprio, J.A. și Garcea, R.L. (2013) Cornul abundenței al virusurilor umane polyoma. Nat.Rev. Microbiol. 11:264-76
- Hussain, I. et al. (2020) Virusurile umane polyoma BK și JC: studiu molecular și prevalențe în Asia. Virus Res. 278:197860
- La Bella, F. și Ozer, H.L. (1985) Replicarea diferențială a ADN-urilor SV40 și polyoma în celulele ovarelor de hamster chinezesc. Virus Res. 2:329-44
- Ehrhardt, A. et al. (2003) Persistența episomală a genomurilor de vectori adenovirali recombinanți în timpul ciclului celular in vivo. J. Virol. 77:7689-95
- Baltimore, D. (1970) ADN polimerază ARN-dependentă în virioni ai virusurilor tumorale ARN Nature 226:1209-11
- Doerfler, W. (2016) Feriți-vă de manipulările genomului: destabilizarea epigenetică prin inserții de ADN (străin). Epigenomics 8:587-91
- Doerfler, W. (1996) Un nou concept în oncogeneza (adenovirală): integrarea ADN-ului străin și consecințele sale. Biochim.Biophys.Acta 1288:F79-99
- Southern, P.J. și Berg, P. (1982) Transformarea celulelor de mamifere pentru rezistență la antibiotice cu o genă bacteriană sub controlul promotorului regiunii timpurii SV40. J. Mol. Appl. Genet. 1:327-41
- Stuchbury, G. și Münch, G. (2010) Optimizarea generării de linii celulare neuronale stabile prin digestia enzimelor de restricție pre-transfecție a ADN-ului plasmidic. Cytotechnology 62:189-94
- Aldén, M. et al. (2022) Transcrierea inversă intracelulară a vaccinului Pfizer BioNTech COVID-19 mRNA BNT162b2 in vitro în linia celulară hepatică umană. Curr.Emite Mol.Biol. 44:1115-1126
- Zhang, L. et al. (2020) SARS-CoV-2 RNA transcris și integrat în genomul uman. bioRxiv DOI:10.1101/2020.12.12.12.422516
- Staal, F.J.T. et al. (2008) Sola dosis facit venenum. Leucemia în studiile de terapie genică: o chestiune de vectori, inserții și dozaj? Leukemia 22:1849-1852
- Kohn, D.B. și Gaspar, H.B. (2017) Cum gestionăm imunodeficiența combinată severă cu deficit de adenozin deaminază (ADA SCID). J. Clin. Immunol. -n/a
- Doerfler, W. et al. (2018) Răspuns epigenetic ereditar față de intrarea ADN-ului străin de către celulele gazdă de mamifere: un gardian al stabilității genomice. Epigenetics 13:1141-1153
- Sipehia, R. și Martucci, G. (1995) Transformarea de înaltă eficiență a celulelor endoteliale umane prin transfecția mediată de Apo E cu ADN plasmidic. Biochem.Biophys.Commun.Res. 214:206-11
- Takahashi, M. et al. (2002) Transformarea celulelor MC3T3-E1 după stres și transfecție cu plasmidul pSV2neo. Anticancer Res. 22:585-98
- Laurema, A. et al. (2003) Transfecția ovocitelor și a altor tipuri de celule ovariene la iepuri după injectarea directă în arterele uterine a adenovirusurilor și a plasmidelor/lipozomilor. Gene Ther. 10:580-4
- Dhup, S. și Majumdar, S.S. (2008) Transgeneza prin integrarea permanentă a genelor în repopularea celulelor spermatogoniale in vivo. Nat.Methods 5:601-3
- Anonymous, (2020) Follow-Up pe termen lung după administrarea produselor de terapie genică umană: Guidance for Industry (Ghid pentru industrie).
- Wang, Z. et al. (2004) Detectarea integrării ADN-ului plasmidic în ADN-ul genomic al gazdei în urma injecției intramusculare și a electroporării. Gene Therapy. 11:711-21
- Anonymous, (2023) Licență internațională Creative Commons Attribution 4.0 (CC BY 4.0).
Publicat inițial în Doctors for Covid Ethics
Suggest a correction







