Γράμματα από τον Υπόκοσμο
IMAGE CREDIT: Shutter Stock
Emails που διέρρευσαν από το EMA Revisited
Στα τέλη του 2020 μια συλλογή εγγράφων – περίπου 900 σελίδες από τα «εμβόλια» της Pfizer της ενότητας Chemistry Manufacturing and Controls (CMC) της ρυθμιστικής υποβολής στον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA), διέρρευσαν και στάλθηκαν σε διάφορους δημοσιογράφους. Τα έγγραφα περιλάμβαναν επίσης ανταλλαγές ηλεκτρονικών μηνυμάτων από ορισμένους αξιολογητές και από ανώτερα στελέχη του EMA. Η διαρροή καλύφθηκε από το British Medical Journal, που ήταν σε θέση να επιβεβαιώσει ότι τα έγγραφα ήταν αυθεντικά. Έλαβα αυτά τα έγγραφα από έναν συνάδελφο περίπου ένα χρόνο αργότερα, στα τέλη του 2021, τα διάβασα και χρησιμοποίησα πολλά από αυτά στις αναλύσεις μου. Έχω δει πολλά έγγραφα της Pfizer σχετικά με την Ε&Α στο πλαίσιο της επαγγελματικής μου εργασίας, οπότε μπορώ επίσης να επιβεβαιώσω ότι αυτά που διέρρευσαν ήταν σε μεγάλο βαθμό συμβατά με την τυπική τεκμηρίωση της Pfizer. Ο EMA δεν αρνήθηκε τη γνησιότητα και δήλωσε μόνο ότι οι επικεφαλίδες ορισμένων από τα μηνύματα ηλεκτρονικού ταχυδρομείου είχαν αλλάξει.
Έχω πολύ μεγαλύτερο αριθμό ακολούθων τώρα και πολύ πιο ξεκάθαρη κατανόηση της οργάνωσης και της ψευδο-νομικής δομής του εγκληματικού καρτέλ που οδηγεί την παγκόσμια θηριωδία, που είναι κοινώς γνωστή ως “απάντηση στην πανδημία Covid”. Επανεξετάζω τα email που διέρρευσαν, καθώς πιστεύω ότι παρέχουν κάποια πολύ σημαντικά στοιχεία.
Τα αρχεία ηλεκτρονικού ταχυδρομείου του EMA που διάβασα περιέχουν 14 στιγμιότυπα οθόνης από μηνύματα ηλεκτρονικού ταχυδρομείου από τα μέσα έως τα τέλη Νοεμβρίου 2020. Οι ανταλλαγές είναι από το προσωπικό του ΕΜΑ και από ανώτερα στελέχη. Κατά τη γνώμη μου, αυτά τα μηνύματα ηλεκτρονικού ταχυδρομείου αποδεικνύουν ότι:
- Οι αξιολογητές του ΕΜΑ βρίσκονταν υπό τεράστια πολιτική πίεση για να εφεύρουν νέους τρόπους έγκρισης των μη εγκεκριμένων επικίνδυνων προϊόντων. Η πίεση προερχόταν από την κορυφή των κυβερνήσεων των ΗΠΑ, του Ηνωμένου Βασιλείου και της ΕΕ.
- Η Επίτροπος της ΕΕ, Ursula von der Leyen, έδωσε υποσχέσεις στα κράτη μέλη τις οποίες δεν σκόπευε ποτέ να εκπληρώσει, προκειμένου να τα δεσμεύσει όλα σε ένα ενιαίο σύμφωνο για τις συμβάσεις εμβολίων και να προλάβει έτσι τυχόν ανεξάρτητες αποφάσεις στις χώρες τους.
- Υπήρχαν σοβαρά και ανεπίλυτα – δεδομένου του σκόπιμα μη ρεαλιστικού χρονοδιαγράμματος – ζητήματα με την ποιότητα του προϊόντος, τα οποία το προσωπικό του ΕΜΑ πιέστηκε να εγκρίνει. Ορισμένοι δεν αισθάνονταν άνετα με αυτό και εξέφραζαν τις ανησυχίες τους. Άλλοι “παρέβλεψαν” δεδομένα που ήταν σαφώς κατασκευασμένα.
Τελικά, η ίδια η ρυθμιστική αναθεώρηση και οι ανησυχίες που προέκυψαν δεν είχαν σημασία – το προϊόν επρόκειτο να διατεθεί στην αγορά όπως και να έχει. Τώρα γνωρίζουμε ακριβώς το γιατί – οι ρυθμιστικές αρχές δεν είχαν τη ρυθμιστική εξουσία επ’ αυτού. Οι ρυθμιστικές αρχές φαρμάκων δεν επιβλέπουν στρατιωτικά μέσα γνωστά ως “αντίμετρα” και “παραγωγή διαδηλώσεων” (κρυφή ορολογία που καλύπτει τους παράγοντες βιολογικού πολέμου που δημιουργήθηκαν από την αιχμάλωτη κυβέρνηση των ΗΠΑ και τους παγκόσμιους εταίρους της). Τα μηνύματα ηλεκτρονικού ταχυδρομείου δείχνουν ότι η πλειοψηφία του προσωπικού του EMA ήταν άθελά τους συμμέτοχοι σε αυτό το έργο.
Η επιβεβαίωση αυτού του γεγονότος για το Ηνωμένο Βασίλειο ήρθε πρόσφατα στη δημοσιότητα.
Με βάση την απάντηση στο MHRA FOIA:
“Όλες οι αποφάσεις αδειοδότησης για τα εμβόλια Covid και την έγκριση των θεραπευτικών προϊόντων ελήφθησαν από τον Υπουργό Αδειών και δεν ανατέθηκαν.”
Μετάφραση – κανονικά η αρμοδιότητα εξέτασης και έγκρισης νέων φαρμακευτικών προϊόντων μεταβιβάζεται επίσημα στο MHRA από τον Υπουργό Υγείας (Ηνωμένο Βασίλειο). Στην περίπτωση των προϊόντων covid, δεν υφίσταται τέτοια εξουσιοδότηση. Φαίνεται ότι όλα αυτά διευθετήθηκαν από τον Matt Hancock (αν και εκείνος ρίχνει τις ευθύνες σε κάποιον ανώτερο). Το ίδιο συνέβη και στις ΗΠΑ – ο Alex Azar υπό την κυβέρνηση Trump, ανέπτυξε αυτά τα μη συμμορφούμενα βιοϋλικά σε Αμερικανούς και ο Xavier Becerra υπό τον Biden συνεχίζει να το κάνει μέχρι σήμερα.
Η πολιτική πίεση.
Η ακόλουθη ανταλλαγή μηνυμάτων ηλεκτρονικού ταχυδρομείου έλαβε χώρα στις 16 Νοεμβρίου 2020 μεταξύ ανώτερων στελεχών του ΕΜΑ:
Noel Wathion – Αναπληρωτής Εκτελεστικός Διευθυντής (συνταξιοδοτήθηκε τον Ιούνιο του 2021):

Agnes Saint-Raymond – επικεφαλής του Τμήματος Διεθνών Υποθέσεων:

Marco Cavaleri, πρόεδρος της Ειδικής Ομάδας για την πανδημία Covid-19 στον ΕΜΑ:

Τα μηνύματα ηλεκτρονικού ταχυδρομείου πρέπει να διαβαστούν από κάτω προς τα πάνω.

Δευτέρα 16/11/2020 12:42 μ.μ
Inbox
Ώρα για λήψη αποφάσεων στην ΕΕ. Αύριο τηλεφώνημα με την Olga και άλλους για να προετοιμαστούν για το EU Exe SG την Τετάρτη.
Τετάρτη EU Exe SG με HoAs.
Πέμπτη TC με τον Επίτροπο.
Η σκοπιμότητα «προσαρμογής» του CMA σε αυτές τις έκτακτες περιστάσεις θα είναι το κλειδί για τον καθορισμό της προσέγγισης.
Saint Raymond Agnes
Δευτέρα 16/11/2020 12:37 μ.μ
Inbox
Ο Αζάρ είναι υπέρ του Τραμπ και εξακολουθεί να βρίσκεται υπό την επιρροή του. Ο Τραμπ εξακολουθεί να κινεί τα νήματα σε αυτό
Καβαλέρι Μάρκο
Δευτέρα 16/11/2020 12:36 μ.μ
Inbox
Υπουργός Υγείας των ΗΠΑ
Wathion Noel
Δευτέρα 16/11/2020 12:35 μ.μ
Inbox
O AZAR τί είναι;
Καβαλέρι Μάρκο
Δευτέρα 16/11/2020 12:34 μ.μ
Inbox
Ο FDA έχει μια κλήση με το MHRA σε 3 ώρες για να συζητήσει τις πτυχές του Biontech CMC. Θα σπεύσουν την EUA (Άδεια Χρήσης Έκτακτης Ανάγκης).
Μάρκο
Ο FDA εξακολουθεί να είναι ασαφής και δεν είναι τ΄όσο εύκολο γι ‘αυτούς να είναι πιο γρήγοροι από τα Χριστούγεννα, αλλά πιέζονται σκληρά από τον Azar και το GOV των ΗΠΑ
Saint Raymond Agnes
Δευτέρα 16/11/2020 12:20 μ.μ
Inbox
Αυτό σημαίνει ότι η MHRA θα εκδώσει σίγουρα EUA (Άδεια Χρήσης Έκτακτης Ανάγκης) ή κάτι ανάλογο πολύ σύντομα…
Μερικές ενδιαφέρουσες παρατηρήσεις: οι τρεις ρυθμιστικές αρχές – ο FDA των ΗΠΑ, ο MHRA του Ηνωμένου Βασιλείου και ο EMA της ΕΕ – είναι όλες απασχολημένες με τον συντονισμό του χρόνου έγκρισης πριν πραγματοποιηθεί οποιαδήποτε επίσημη εξέταση των δεδομένων, προτού οι συμβουλευτικές επιτροπές δουν τα αποτελέσματα των κλινικών δοκιμών, τα συζητήσουν, τα ψηφίσουν κ.λπ. Συζητούν για το χρόνο έγκρισης σαν τα δεδομένα να ΜΗΝ ΕΧΟΥΝ ΣΗΜΑΣΙΑ για το αν τα προϊόντα αυτά θα κυκλοφορήσουν στην αγορά ή όχι. Επιπλέον, αλληλεπιδρούν σαν να μην είναι τρεις ξεχωριστές υπηρεσίες ξεχωριστών κυρίαρχων εθνών που είναι υπεύθυνες για ξεχωριστά σύνολα φορολογουμένων και βουλευτική/κοινοβουλευτικής εποπτείας, αλλά απλά γραφειοκρατικές υπηρεσίες που έχουν ήδη συγχωνευθεί σε μια παγκόσμια κυβέρνηση. Τέλος, ο FDA πρόκειται να “σπεύσει την EUA”, “ωθούμενος από τον Azar” (Alex Azar – τότε Υπουργός Υγείας) και “ο Trump κινεί τα νήματα”.
Πολλοί άνθρωποι με ρωτούν πώς είναι δυνατόν να συμμετείχαν χιλιάδες άνθρωποι στην απάτη που ενορχηστρώθηκε ως “αντιμετώπιση της πανδημίας covid” – σίγουρα δεν είναι δυνατόν να συνεργάζονται τόσοι πολλοί άνθρωποι! Δεν ήταν απαραίτητο να υπάρχουν τόσοι πολλοί που γνώριζαν. Εδώ, ο Noel Wathion, κορυφαίο στέλεχος της EMA, είτε δεν γνωρίζει ότι η αναθεώρηση των δεδομένων είναι άσχετη με το αν οι ενέσεις θα κυκλοφορήσουν τελικά στην αγορά, είτε το παραποιεί επιδέξια (στην πραγματικότητα πιστεύω ότι δεν το γνώριζε). Ως εκ τούτου, το προσωπικό της ΕΜΑ που βρίσκεται κάτω από αυτόν δεν θα έπρεπε να γνωρίζει και απλώς θα βιαζόταν να εκτελέσει το όποιο καθήκον του είχε ανατεθεί. Η διαμερισματοποίηση είναι το κλειδί για την κάλυψη οποιασδήποτε μεγάλης απάτης εντός μεγάλων οργανισμών και πολύπλοκων δομών. Αυτός είναι ο λόγος για τον οποίο παραιτήθηκε/συνταξιοδοτήθηκε λίγο μετά την κυκλοφορία των kill shots; Βρίσκεται επίσης υπό την πίεση της ΕΚ (Ευρωπαϊκής Επιτροπής) να τα εγκρίνει. Και η Pfizer θέλει τώρα μια πλήρη Άδεια Κυκλοφορίας (ΑΚ) αντί για την υπό όρους (ΑΚ)! Σημείωση – το CMA εκδόθηκε, αλλά οι όροι δεν εκπληρώθηκαν ποτέ από την Pfizer/BioNTech, γιατί ποιος νοιάζεται, ήταν ένα παιχνίδι από την αρχή.
“(Co)-Rapps” = συν-εισηγητές. Ο EMA είναι μια ευρωπαϊκή οντότητα, που αποτελείται από τις πρώην ξεχωριστές “αρμόδιες αρχές” των κρατών μελών, οι οποίες συνήθιζαν να ρυθμίζουν και να εγκρίνουν τα φαρμακευτικά προϊόντα σε κάθε χώρα ξεχωριστά. Στην ευρωπαϊκή δομή, η ομάδα τεχνικού ελέγχου και συν-αναθεώρησης επιλέγεται για ένα συγκεκριμένο προϊόν. Στην περίπτωση των “εμβολίων” covid, η σουηδική ομάδα με επικεφαλής τον Philip Josephson ήταν ο εισηγητής (lead reviewer) και η γαλλική ομάδα με επικεφαλής τον Jean-Michel Race – ο συνεισηγητής. “CHMP” =Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (στον ΕΜΑ).

Αποστολή: Κυριακή, 22 Νοεμβρίου 2020 17:19
Προς: SOLOMON Olga (SANTE)
Θέμα: RE: Εμβόλια Covid: ροή πληροφοριών για τις επόμενες εβδομάδες
Αγαπητή Όλγα,
Φυσικά, μπορούμε να συζητήσουμε τη Δευτέρα πώς να παρέχουμε καλύτερα ενημερώσεις στην EC σχετικά με τις εξελίξεις σε πραγματικό χρόνο για αυτά τα πρώτα εμβόλια. Ας δούμε πώς να το πετύχουμε καλύτερα.
Τρία σχόλια θα ήθελα να κάνω επιπλέον:
Η πιθανότητα η FDA (και επίσης το MHRA) να εκδώσει EUA πριν από τη χορήγηση CMA είναι εξαιρετικά υψηλή. Πρέπει λοιπόν να προετοιμαστούμε για αυτό. Σίγουρα το κοινό και τα ΜΜΕ δεν θα καταλάβουν την διαφορά…για αυτούς η “εξουσιοδότηση” είναι εξουσιοδότηση. Έχουμε επιλογές για να το αντιμετωπίσουμε, από τον περιορισμό της ζημίας στην προληπτική διαχείριση προσδοκιών. Πρέπει να επιλέξουμε ποια επιλογή είναι η καλύτερη λαμβάνοντας υπόψη τις ακριβείς συνθήκες.
Επιταχύνουμε όσο το δυνατόν περισσότερο, αλλά πρέπει επίσης να διασφαλίσουμε ότι η επιστημονική μας αξιολόγηση είναι όσο το δυνατόν πιο ισχυρή. Ας μην ξεχνάμε την ευθύνη/υπευθυνότητα που συνδέεται με τη σύσταση προς την ΕΚ για χορήγηση CMA. Και χρειαζόμαστε την υποστήριξη των (Co)-Rapps και της CHMP για να το πετύχουμε. Χωρίς αυτούς δεν θα γίνει.
Το γεγονός ότι η εταιρεία τώρα ξαφνικά θέλει να πάρει ένα πλήρες MA αντί για ένα CMA μπορεί ακόμη και να κάνει τα πράγματα πιο δύσκολα…
Θερμούς χαιρετισμούς,
Noel
Το ηλεκτρονικό μήνυμα απευθύνεται στην Olga Solomon και στην EC (Ευρωπαϊκή Επιτροπή), και αντιγράφεται στο αφεντικό του Noel, Emer Cooke -εκτελεστικό διευθυντή του EMA και πρώην ανώτερο στέλεχος του ΠΟΥ. Εδώ είναι η Emer Cooke:

Η έξυπνη συμφωνία της Ούρσουλα.
Τη θυμάστε

Ursula von der Leyen – Επίτροπος της ΕΕ, στα επιτεύγματα της οποίας περιλαμβάνεται η διαπραγμάτευση απίστευτων αρπαχτικών συμβάσεων προμήθειας της Pfizer για λογαριασμό όλων των κρατών μελών της ΕΕ μέσω γραπτών μηνυμάτων με τον διευθύνοντα σύμβουλο της Pfizer Albert Bourla. Σε αυτές τις συμβάσεις οι χώρες της ΕΕ έπρεπε να βάλουν κρατικά περιουσιακά στοιχεία ως εγγύηση, να παραιτηθούν από όλους τους νόμους για τον έλεγχο της ποιότητας, την εισαγωγή και την προστασία των καταναλωτών και να παραιτηθούν από την εθνική τους κυριαρχία – δηλαδή να μην επιτρέπεται να αλλάξουν τη νομοθεσία όσον αφορά την ευθύνη των εμβολίων στα δικά τους κοινοβούλιά. Οι αρπαχτικές αυτές συμβάσεις που ήταν πλήρως διασκευασμένες για την προστασία των λεγόμενων “εμπορικών συμφερόντων της Pfizer”. Η ακόλουθη ανταλλαγή μηνυμάτων ηλεκτρονικού ταχυδρομείου σχετίζεται με τις γενναίες προσπάθειες της Ursula:

Απλά μια προειδοποίηση: μόλις ολοκληρώσαμε την TC μεταξύ του Επιτρόπου και του ECDC/EMA, στην οποία ο Επίτροπος έθεσε ερωτήσεις σχετικά με την αναμενόμενη έγκριση του εμβολίου Pfizer και το χρονοδιάγραμμα έγκρισης FDA έναντι ΕΕ. Έτσι, αυτόματα προέκυψε το θέμα του εθνικού Art 5(2) vs CMA, το οποίο ο Noel εξήγησε λεπτομερώς και επίσης πώς σκοπεύουμε να το συζητήσουμε περαιτέρω με τις ΕΑΑ την επόμενη εβδομάδα και στο HMA. Ο Guido πρότεινε επίσης να εξετάσει το ενδεχόμενο να το συζητήσει με τους Υπουργούς Υγείας στην EPSCO.
Η Sandra και ο Giorgios είπαν ότι θα συζητήσουν περαιτέρω και στο SANTE, επομένως, εξ ου και το email μου σε εσάς.
(παρών ήταν και ο Andrzej)
Σημείωση επίσης:
Ο Επίτροπος είπε ότι, εφόσον η EC δεσμεύτηκε προς το MSS και το ΕΚ ότι τα εμβόλια θα είναι διαθέσιμα σε όλα τα MSS ταυτόχρονα – και ότι επομένως θα είναι σημαντικό τα κράτη μέλη να μην «αναγκαστούν» να χρησιμοποιήσουν αυτήν την εθνική διαδρομή λόγω «καθυστερήσεων» στην επίσημη διαδικασία έγκρισης.
Είπε επίσης ότι θα είναι έτοιμη να καλέσει προσωπικά τους αρμόδιους υπουργούς Υγείας για να αποφύγει τη χρήση του άρθρου 5 παράγραφος 2.
Τις καλύτερες ευχές,
Χίλντε
Χρησιμοποιούνται ένα σωρό ακρωνύμια, τα πιο σημαντικά είναι: “EC” = Ευρωπαϊκή Επιτροπή, “MS” = κράτη μέλη, “EP”=Ευρωπαϊκό Κοινοβούλιο. Η φράση-κλειδί είναι ότι η Ursula είναι “έτοιμη να καλέσει προσωπικά τους αρμόδιους υπουργούς υγείας για να αποφύγει τη χρήση του άρθρου 5 παράγραφος 2” . Τι σημαίνει αυτό; Το άρθρο 5(2) αναφέρεται στο “άρθρο 5(2) της οδηγίας 2001/83” – άδεια χρήσης έκτακτης ανάγκης σε ένα ευρωπαϊκό κράτος μέλος, η οποία δίνεται από κάθε κράτος μέλος ξεχωριστά στις χώρες του. Η CMA είναι μια ΄Άδεια Κυκλοφορίας Υπό Όρους, η οποία εκδίδεται από τον EMA για όλα τα μέλη της ΕΕ ταυτόχρονα. Διαφημίζεται από την ΕΕ ως μια πολύ πιο ισχυρή διαδικασία από μια EUA (η έμφαση προστέθηκε από εμένα):
…Η CMA ακολουθεί ένα ελεγχόμενο και ισχυρό πλαίσιο που παρέχει εγγυήσεις που οι άδειες χρήσης έκτακτης ανάγκης ενδέχεται να μην παρέχουν. Στην πραγματικότητα, μια άδεια χρήσης έκτακτης ανάγκης δεν αποτελεί έγκριση του εμβολίου αλλά έγκριση της προσωρινής χρήσης του μη εγκεκριμένου εμβολίου. Η CMA διασφαλίζει ότι όλοι οι έλεγχοι φαρμακοεπαγρύπνησης, οι έλεγχοι παρασκευής, συμπεριλαμβανομένων των ελέγχων παρτίδων για τα εμβόλια, και άλλες υποχρεώσεις μετά την έγκριση εφαρμόζονται με νομικά δεσμευτικό τρόπο […]. Ειδικότερα:
-Εξασφαλίζει την αυστηρή παρακολούθηση, μέσω του συστήματος φαρμακοεπαγρύπνησης της ΕΕ, της ασφάλειας του φαρμάκου σε ολόκληρη την ΕΕ. […]
-Εξασφαλίζει την παρακολούθηση της ασφάλειας μετά την έγκριση και επιτρέπει τη συλλογή πρόσθετων δεδομένων με δομημένο τρόπο. […].
-Η προσεχτική παρασκευή, συμπεριλαμβανομένης της απελευθέρωσης παρτίδων για τα εμβόλια και τη διανομή, υπόκειται στους ίδιους συνεχείς ελέγχους όπως για όλα τα εγκεκριμένα φάρμακα. Η παρακολούθηση των διαδικασιών παρασκευής διασφαλίζει ότι το φάρμακο παρασκευάζεται και ελέγχεται σύμφωνα με υψηλά φαρμακευτικά πρότυπα στο πλαίσιο της εμπορίας μεγάλης κλίμακας.
Στο πλαίσιο μιας άδειας κυκλοφορίας υπό όρους (CMA) της ΕΕ, η ευθύνη βαρύνει τον κάτοχο της άδειας κυκλοφορίας. Ο κάτοχος της άδειας κυκλοφορίας είναι υπεύθυνος για το προϊόν και την ασφαλή χρήση του.
Αυτό ακούγεται καταπληκτικό στη θεωρία. Αυτό υποσχέθηκε η Ούρσουλα όταν τηλεφώνησε προσωπικά και εξανάγκασε τους πολιτικούς στα κράτη μέλη. Ίσως ο εξαναγκασμός να μην ήταν καν απαραίτητος, καθώς είχαν τρομοκρατηθεί επαρκώς από την προπαγάνδα για τον covid και περίμεναν τα θαυματουργά “εμβόλια” για να τους σώσουν. Το πρόβλημα είναι ότι η Ούρσουλα δεν είχε ποτέ σκοπό να εκπληρώσει αυτές τις υποσχέσεις, και σε κάθε περίπτωση, δεν είναι δυνατόν να παραχθούν τα “εμβόλια” mRNA με την ασφάλεια, την αποτελεσματικότητα και την ποιότητα παρασκευής που απαιτείται για φαρμακευτικά προϊόντα. Αυτό που χρειαζόταν πραγματικά η Ursula από αυτή τη διαδικασία ήταν να δέσει όλα τα ευρωπαϊκά κράτη μέλη σε ένα σύμφωνο, υποσχόμενη μια “ισχυρή” CMA, ώστε να μην μπορούν να έχουν ανεξάρτητη εξουσία για τα εμβόλια που διανέμονται στις χώρες τους. Η διαδρομή του άρθρου 5 θα σήμαινε ότι κάθε ΚΜ θα μπορούσε να εγκρίνει το προϊόν και στη συνέχεια θα είχε την εξουσία να ανακαλέσει την έγκριση εάν εντοπίζονταν προβλήματα. Το άρθρο 5 προβλέπει επίσης απαλλαγή από την ευθύνη του κατασκευαστή, ωστόσο καθιστά αδύνατη την διαταγή για το προϊόν. Με τη διαδρομή της CMA κανένα από τα ΚΜ δεν θα μπορούσε να ασκήσει την ανεξάρτητη λήψη αποφάσεων, και έτσι θα μπορούσε στη συνέχεια να τα αναγκάσει όλα να υπογράψουν τις ίδιες, παράλογες και σχεδόν πλήρως αναδιατυπωμένες συμβάσεις της Pfizer, της Moderna και της AstraZeneca, οι οποίες ούτως ή άλλως παραιτούνταν από κάθε ευθύνη και επιπλέον απαγόρευαν στις χώρες να αλλάξουν τους δικούς τους νόμους όσον αφορά την ευθύνη!
Οι αγοραστές πρέπει “να αποζημιώσουν, να υπερασπιστούν και να κρατήσουν αβλαβή την Pfizer … από και ενάντια σε όλες τις αγωγές, αξιώσεις, ενέργειες, απαιτήσεις, απώλειες, ζημίες, ευθύνες, διακανονισμούς, ποινές, πρόστιμα, έξοδα και δαπάνες … που προκύπτουν από, σχετίζονται με ή προκύπτουν από το εμβόλιο.”
Αξιοσημείωτες σημαντικές ενστάσεις και η έλλειψη τους από τους κριτές του EMA.
Το τμήμα Χημικής Παραγωγής και Ελέγχου (CMC) της Αίτησης Άδειας Βιολογικού Προϊόντος αποτελεί τον κύριο πυλώνα της ρυθμιστικής έγκρισης. Περιγράφει τη διαδικασία παρασκευής και τη συμμόρφωση με τις Ορθές Παρασκευαστικές Πρακτικές (cGMP) και το εκτεταμένο σύνολο νόμων και κανονισμών που έχουν σχεδιαστεί για να διασφαλίζουν την καθαρότητα, τη δραστικότητα, τη συνέπεια και την ασφάλεια των μαζικά παραγόμενων φαρμάκων και βιολογικών προϊόντων. Τα δεδομένα ασφάλειας και αποτελεσματικότητας από τις κλινικές δοκιμές είναι άχρηστα εάν ο παρασκευαστής δεν μπορεί να διαβεβαιώσει τις ρυθμιστικές αρχές και την ιατρική κοινότητα ότι: 1) το εν λόγω προϊόν, σύμφωνα με τις προδιαγραφές, χρησιμοποιήθηκε στις κλινικές δοκιμές, 2) το προϊόν παρασκευάζεται με συνέπεια, είναι καθαρό, υψηλής ποιότητας, αναπαραγώγιμο, με καλά χαρακτηρισμένη και προβλέψιμη διαδικασία παρασκευής και βήματα ελέγχου, 3) το ίδιο προϊόν με αυτό που δοκιμάστηκε θα διανεμηθεί στο εμπόριο.
Εντοπίστηκαν προβλήματα στο τμήμα CMC της υποβολής της Pfizer:

Μετάφραση κειμένου εικόνας: Cavaleri Marco, Τρίτη 10/11/2020 – Μόλις έμαθα από τον FDA ότι υπάρχουν ορισμένα ζητήματα σχετικά με το CMC που πρέπει να διευθετηθούν, οπότε υποθέτω ότι αν μπορούμε να προσπαθήσουμε να καλύψουμε τη διαφορά, θα ήταν καλό. Φοβάμαι ότι το CMC θα καταλήξει να είναι το δύσκολο κομμάτι
Η FDA μπορεί να συνάψει το EUA έως τα Χριστούγεννα (όχι νωρίτερα). υπάρχουν πιθανότητες να εκδώσουμε CMA ταυτόχρονα;
Rager Irene
Τρίτη 10/11/2020 13:32
Marco
Δες παρακάτω τα χρονοδιαγράμματα της BNT.
Σύσταση ETF για υποβολή CMA, επομένως νωρίτερα την Πέμπτη την επόμενη εβδομάδα (19/11)
Επί του παρόντος, η δεύτερη υποβολή CMC έχει προγραμματιστεί για τις 18 Δεκεμβρίου – πρέπει να την αποδεχτούμε ως πιθανή ημερομηνία υποβολής CMA και να σχεδιάσουμε ανάλογα ή πρέπει να προσπαθήσουμε να ξεκινήσουμε το CMC ακόμη νωρίτερα (αρχές Δεκεμβρίου) και να εισαγάγουμε το 2ο κύμα CMC κατά τη διαδικασία MAA;
Αυτό θα ήταν σημαντικό για να πιέσουμε περαιτέρω τους αξιολογητές CMC, οι οποίοι προφανώς επέστρεψαν διεκδικώντας ένα πιο αυστηρό TT για τον 1ο γύρο CMC.
Η άποψή σας;
Ευχαριστώ και με εκτίμηση,
Irene.
Οι αξιολογητές του CMC δεν ήταν ευχαριστημένοι με το χρονοδιάγραμμα που δόθηκε για την αξιολόγηση, δεδομένου ότι παραβίαζε όλα τα κανονικά χρονοδιαγράμματα και τα επιταχυνόμενα, επίσης, με μεγάλη διαφορά. Έτσι, η λύση ήταν ότι οι αξιολογητές έπρεπε απλώς να “πιεστούν”. Αυτό πέτυχε μόνο έναν στόχο – να πιέσουν τους ανθρώπους που θα μπορούσαν ενδεχομένως να έχουν εκφράσει ανησυχίες στα όρια της εξάντλησης, ώστε απλά να παραιτηθούν και να συμμορφωθούν. Άλλωστε, όσοι βρίσκονταν στην κορυφή γνώριζαν καλά ότι η ρυθμιστική αξιολόγηση δεν είχε καμία σημασία και καμία επίπτωση στην ψεύτικη “έγκριση”, θα συνέβαινε ό,τι κι αν γινόταν. Στο Ηνωμένο Βασίλειο, η MHRA παραδέχθηκε ήδη ότι δεν είχε καμία επίσημη εξουσιοδότηση για την αναθεώρηση και έγκριση αυτών των ενέσεων, και είμαι πρόθυμη να στοιχηματίσω ότι ούτε ο EMA είχε τέτοια εξουσιοδότηση.
Οι αξιολογητές χαμηλού επιπέδου της CMC δεν το γνώριζαν αυτό και εργάζονταν πολύ σκληρά και πιθανότατα με καλή πίστη. Μέχρι τα τέλη Νοεμβρίου, διατύπωσαν 140+ επίσημες ενστάσεις στην υποβολή CMC της Pfizer, η οποία εξακολουθούσε να έχει πολλά κενά και ελλείπουσες πληροφορίες. Να αναφέρω ότι, 10-15 ρυθμιστικές ενστάσεις συνήθως σταματούν την προώθηση μιας φαρμακευτικής αίτησης μέχρι να επιλυθούν οι ενστάσεις. Τρεις Μείζων Ενστάσεις, δηλαδή επίσημες κόκκινες σημαίες, συζητούνται συγκεκριμένα στα παρακάτω μηνύματα ηλεκτρονικού ταχυδρομείου. Εγώ και άλλοι γράψαμε εκτενώς για τη ΜΟ#2 (έλλειψη ακεραιότητας του mRNA). Ακολουθεί ένα μήνυμα ηλεκτρονικού ταχυδρομείου από έναν από τους αξιολογητές, την Ευδοκία Κορακιανίτη και μια απάντηση από τον Alexis Nolte που συζητά το πρόβλημα και τις επιπτώσεις (εντελώς άγνωστες και ενδεχομένως πολύ ανησυχητικές) στην αποτελεσματικότητα και την ασφάλεια του προϊόντος:

Ευδοκία.
Ένας τρόπος για να κατανοήσουμε πώς το χαμηλότερο επίπεδο mRNA στο τελικό προϊόν μεταφράζεται σε αποτελεσματικότητα θα ήταν να μετρηθεί εάν επηρεάζει σημαντικά τα επίπεδα έκφρασης πρωτεΐνης. Μπορεί το επίπεδο της αντιγονικής πρωτεΐνης που εκφράζεται να μην επηρεάζεται σημαντικά. Ωστόσο, δεν ξέρω εάν υπάρχει μια δοκιμή που θα επέτρεπε την πρόβλεψη του αντίκτυπου στην αποτελεσματικότητα χωρίς κλινική δοκιμή για συγκρησιμότητα.
Αλέξης
Κορακιανίτη Ευδοκία
Δευτ. 23/11/2020 10:38
Inbox
Αγαπητοί συνάδελφοι,
Αυτό το μήνυμα ηλεκτρονικού ταχυδρομείου είναι για ενημέρωση και επισήμανση ενός σημαντικού ζητήματος συγκρισιμότητας με το εμβόλιο BioNTech που πρέπει να αντιμετωπιστεί πριν από την έγκριση.
Θέμα: Έχει παρατηρηθεί σημαντική διαφορά στην ακεραιότητα %RNA / περικομμένα είδη μεταξύ των κλινικών παρτίδων (~ 78% ακεραιότητα mRNA) βάσει των οποίων η ενδιάμεση ανάλυση
πραγματοποιήθηκε και οι προτεινόμενες εμπορικές παρτίδες (~ 55%).
Η εταιρεία ισχυρίζεται ότι η αποτελεσματικότητα του φαρμακευτικού προϊόντος εξαρτάται από την έκφραση του παρεχόμενου RNA, το οποίο απαιτεί ένα επαρκώς άθικτο μόριο RNA. Η βασική αιτία για τη χαμηλότερη ακεραιότητα %RNA σε εμπορικές παρτίδες δεν έχει ακόμη εντοπιστεί
Αντίκτυπος: Οι πιθανές επιπτώσεις αυτής της απώλειας ακεραιότητας RNA σε εμπορικές παρτίδες σε σύγκριση με κλινικές όσον αφορά τόσο την ασφάλεια όσο και την αποτελεσματικότητα δεν έχουν ακόμη καθοριστεί. Το εάν τα παρατηρούμενα ζητήματα συγκρισιμότητας θα μπορούσαν να αποτελέσουν σημείο αποκλεισμού θα εξαρτηθεί από τη συνάφεια αυτών των παρατηρήσεων με την ασφάλεια και την αποτελεσματικότητα και θα ζητηθεί από την εταιρεία να δικαιολογήσει πλήρως τη χαμηλότερη ακεραιότητα %RNA (και άλλες διαφορές που σημειώθηκαν).
Σημείο συζήτησης θα είναι εάν τα ζητήματα συγκρισιμότητας μπορούν να επιλυθούν μόνο με δεδομένα ποιότητας (πρόσθετα λειτουργικά/ βιολογικά δεδομένα in vitro + διαθέσιμα μη κλινικά) ή ότι θα χρειαστούν περαιτέρω κλινικά δεδομένα (υπάρχουν/θα διεξαχθούν μελέτες γεφύρωσης). Είναι δύσκολο να γίνουν προβλέψεις για αυτό.
Μελλοντική πορεία: Αυτό το ζήτημα και άλλοι MO (αλλά κατά την άποψή μας δεν εμποδίζουν μια πιθανή έγκριση) έχουν τεθεί στο ETF και συζητούνται στο BWP αυτή την εβδομάδα και σε μια επιτροπή με τον FDA την Τετάρτη
Ευχαριστώ πολύ τον Ton που είναι ο ειδικός ποιότητας για αυτό το εμβόλιο μαζί με τον Brian φροντίζουν τα χημικά στοιχεία
τις καλύτερες ευχές
Ευδοκία
Το πρόβλημα της αποικοδόμησης του mRNA συζητήθηκε επίσης από τους ειδικούς σε θέματα ποιότητας CMC Ton van der Stappen, ανώτερο εμπειρογνώμονα βιοφαρμακευτικών προϊόντων στο Συμβούλιο Αξιολόγησης Φαρμάκων (με έδρα την Ολλανδία) και ειδικό σε θέματα ποιότητας για τον EMA:

και ο Brian Dooley, άλλος ειδικός φαρμακευτικής ποιότητας στον EMA:

Οι παρακάτω εικόνες προέρχονται από την αξιολόγηση ποιότητας που υπέβαλαν στον EMA. Η πρώτη εικόνα μιλάει για το καλά τεκμηριωμένο πλέον θέμα της αποικοδόμησης του mRNA σε διάφορες παρτίδες του προϊόντος της Pfizer. Εδώ τα αποτελέσματα της ανάλυσης των παρτίδων που παρέδωσε η Pfizer παρατίθενται και είναι χρωματικά κωδικοποιημένα ανά διαφορετικές τοποθεσίες παραγωγής, καθώς και ανά φαρμακευτική ουσία και κατηγορία φαρμακευτικού προϊόντος. Φαρμακευτική ουσία = ενεργά συστατικά του προϊόντος (μόνο το mRNA) και φαρμακευτικό προϊόν είναι η ουσία που είναι διαμορφωμένη στα λιπίδια και άλλα συστατικά. Το % ακεραιότητας mRNA περιγράφει το % του “πλήρους μήκους” mRNA που ανιχνεύθηκε σε μια παρτίδα. το άλλο μέρος της παρτίδας αποτελούνταν από άγνωστα σπασμένα κομμάτια με άγνωστες ιδιότητες ή επιπτώσεις στην ασφάλεια. Σημειώστε ότι κανένας ανεξάρτητος έλεγχος για κανένα από αυτά δεν πραγματοποιήθηκε από τις ρυθμιστικές αρχές, απλώς απαριθμούσαν τους αριθμούς που παρείχε η Pfizer/BioNTech.
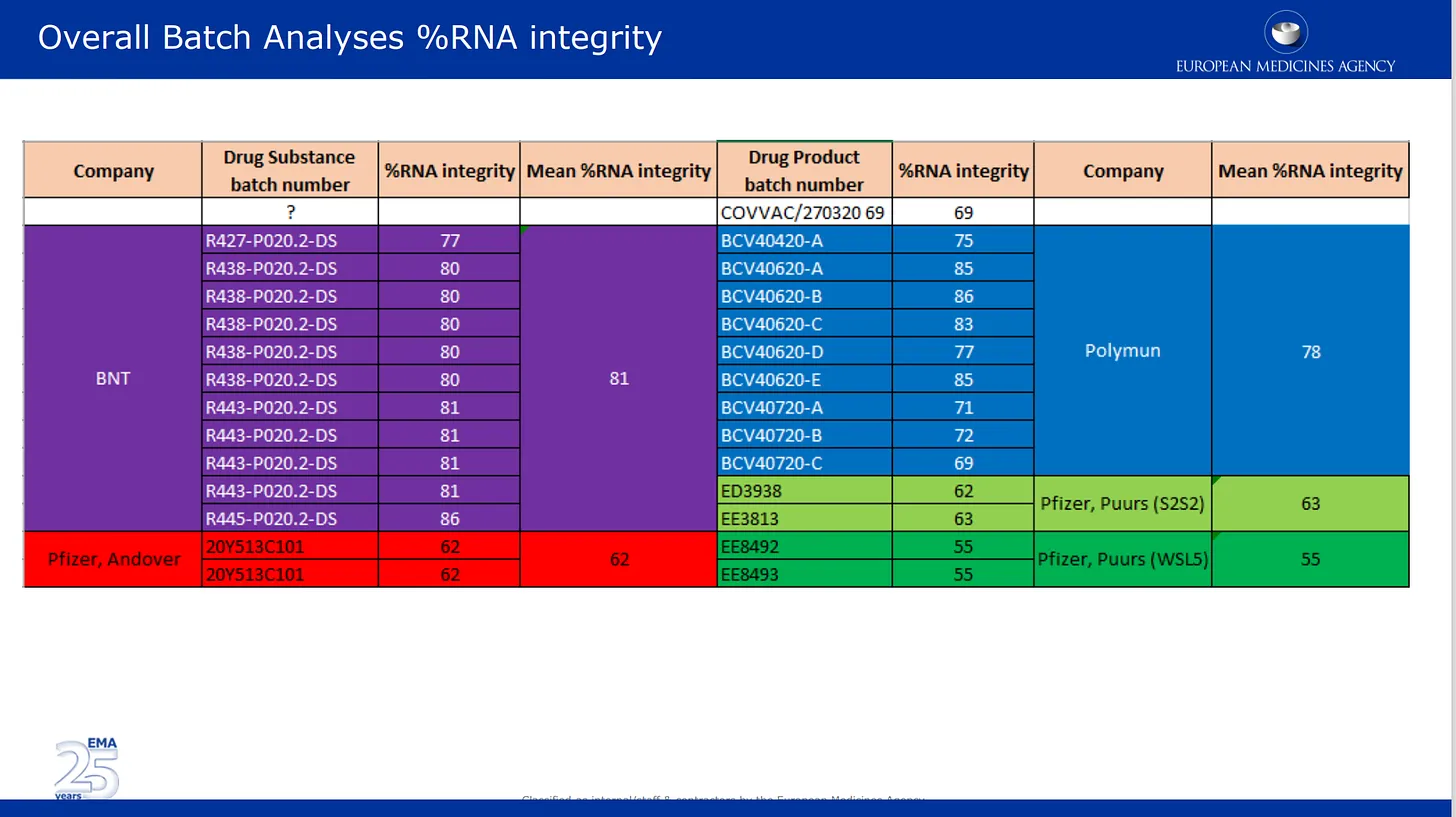
Φαίνεται ότι αυτοί οι δύο επιστημονικοί σύμβουλοι εξέτασαν και αποδέχθηκαν τις ψεύτικες εικόνες των αποτελεσμάτων των Western blot που υπέβαλε η Pfizer στον EMA – εδώ είναι στη δική τους παρουσίαση PowerPoint της αναθεώρησης από τις 24 Νοεμβρίου 2020. Διαβάστε τη σημείωση κάτω από τη διαφάνεια – αποδέχονται αυτές τις εικόνες ως πραγματικές, παρόλο που και οι δύο αυτοί αναλυτές θα έπρεπε να γνωρίζουν καλύτερα. Γιατί ΔΕΝ διαμαρτυρήθηκαν γι’ αυτό; Αυτό λέει το σημείωμα:
Το μέγεθος της πρωτεΐνης μετά την in-vitro έκφραση της φαρμακευτικής ουσίας BNT162b2 προσδιορίστηκε με τη χρήση Western blot. Το μέγεθος της εκφραζόμενης πρωτεΐνης επιβεβαιώθηκε ότι είναι συγκρίσιμο για τρεις παρτίδες της διαδικασίας 1 και την παρτίδα της διαδικασίας 2. Το σχήμα 3.2.S.2.6-15 δείχνει ότι το μέγεθος της εκφραζόμενης πρωτεΐνης είναι σύμφωνο με το αναμενόμενο μέγεθος της φαρμακευτικής ουσίας BNT162b2 και συγκρίσιμο σε όλες τις δοκιμασμένες παρτίδες. Επιπλέον, τα σχετικά επίπεδα έκφρασης είναι συγκρίσιμα για όλες τις παρτίδες, όπως αποδεικνύεται από τη συγκρίσιμη ένταση ζώνης σε κάθε επίπεδο φόρτισης σε όλες τις παρτίδες.

Ίσως κάποιοι σκληροί δημοσιογράφοι θα πρέπει να απευθυνθούν στους Drs. van der Stappen και Dooley, καθώς και στην κα Κορακιανίτη και άλλα άτομα που αναφέρονται εδώ για σχολιασμό.
Είναι προφανές από τις απαντήσεις που έθεσε η Ευδοκία Κορακιανίτη ότι η διοίκηση του EMA παραιτήθηκε και βασίστηκε σε “δεδομένα που μόνο ο FDA έχει δει”, αλλά είναι “αισιόδοξη” και ότι ο FDA ισχυρίστηκε ότι η θραύση του mRNA ήταν “θεωρητική ανησυχία”. Αλήθεια; Υπάρχουν δεδομένα που να υποστηρίζουν αυτή τη δήλωση ή όχι; Εδώ είναι τα μηνύματα ηλεκτρονικού ταχυδρομείου που δείχνουν ότι οι μείζονες ενστάσεις συντάχθηκαν επίσημα και στη συνέχεια αγνοήθηκαν από τον EMA, καθώς το προϊόν απεστάλη εμπορικά μόλις μερικές εβδομάδες αργότερα. Οι όροι της CMA δεν εκπληρώθηκαν ποτέ.
Αυτό επιβεβαιώνει αυτό που ήδη γνωρίζουμε – ούτε ο EMA (ούτε ο FDA, ο Health Canada, ο MHRA ή άλλες ρυθμιστικές αρχές) είχαν πραγματική εξουσία επί αυτών των προϊόντων ή αντίκτυπο στο αν επρόκειτο να διανεμηθούν στο ανυποψίαστο κοινό. Όλα ήταν θέατρο από την αρχή μέχρι το τέλος.
Ακολουθούν οι τρεις Μείζων Ενστάσεις που παραμένουν άλυτες μέχρι σήμερα:

Προς: Κορακιανίτη Ευδοκία
Θέμα: ενημέρωση από τη συνάντηση BWP στο BioNTech
Αγαπητή Ευδοκία,
Το BWP μόλις συζήτησε το BioNTech BWP και παρακάτω θα βρείτε τα κύρια συμπεράσματα:
Ο φάκελος είναι γενικά καλής ποιότητας λαμβάνοντας υπόψη την ταχύτητα ανάπτυξης και συλλογή. – 3 μεγάλες ενστάσεις συμφωνούνται:
– MO1: Οι απομακρυσμένες αξιολογήσεις GMP για τοποθεσίες παραγωγής στις ΗΠΑ (Σημείωση: Η αξιολόγηση απόστασης στην τοποθεσία Wyeth, Andover (DS, QC DS, QC DP) και στην τοποθεσία Pfizer, Chesterfield (QC DS, QC DP) είναι συνεχείς ενδιάμεσες αναφορές που αναμένονται στις 11 Δεκεμβρίου 2020, ο MO αναδιατυπώθηκε για να επιτρέπει τη δήλωση GMP)
– MO2: Διαφορές στο επίπεδο της ακεραιότητας του mRNA. αμφισβητείται η συγκρισιμότητα μεταξύ κλινικού και εμπορικού υλικού, DS και DP (Σημείωση: ανάλυση βασικής αιτίας σε εξέλιξη 2 επιπλέον παρτίδες PPQ που κατασκευάστηκαν με ελαφρώς προσαρμοσμένη διαδικασία – αναμονή για αποτελέσματα, εάν η ακεραιότητα RNA βελτιωθεί ξανά στα αρχικά επίπεδα, αυτό θα μπορούσε να γίνει αποδεκτό / χαρακτηρισμός ζητήθηκαν δεδομένα για την κατανόηση της μεταβλητότητας των πρωτεϊνών από θραύσματα mRNA → πιθανή επίπτωση στην ασφάλεια).
– MO3: Εκκρεμείς παρτίδες PPQ για DP: συγκρισιμότητα, επικύρωση διεργασίας και σταθερότητα (Σημείωση: όπως παραπάνω: 2 παρτίδες PPQ που κατασκευάστηκαν και βρίσκονται υπό δοκιμή).
– Σημειώστε ότι πλήρεις πληροφορίες για δύο νέα έκδοχα (λιπίδιο στα νανοσωματίδια) δεν παρέχονται
ακόμη. Αυτά τα δεδομένα αναμένονται στο επόμενο κύμα CMC.
Συμπεράσματα: εξακολουθούν να υπάρχουν ορισμένες σημαντικές ανησυχίες που επηρεάζουν το όφελος/κίνδυνο του εμβολίου (αποτελεσματικότητα/ασφάλεια), κυρίως το ζήτημα της συγκρισιμότητας γύρω από το % ακεραιότητα του mRNA. Αυτές οι ανησυχίες συμμερίζονται τα περισσότερα κράτη μέλη. Μια έγκριση έως το τέλος του έτους θα μπορούσε ενδεχομένως να είναι δυνατή, εάν αυτές οι ανησυχίες + GMP επιλυθούν. Οποιαδήποτε εναπομείναντα ζητήματα ποιότητας θα πρέπει να εξεταστούν στο πλαίσιο του συνολικού B/R (και θα μπορούσαν ενδεχομένως να αντιμετωπιστούν μέσω ειδικών υποχρεώσεων/προϋποθέσεων/συστάσεων του Παραρτήματος II).
Η έκθεση BWP που αντικατοπτρίζει αυτά τα συμπεράσματα βρίσκεται υπό γραπτή έγκριση σήμερα. Ευχαριστώ τον Ton, τον Brian και τον Claudio,
Θερμούς χαιρετισμούς,
Βερόνικα
Veronika Jekerle, PhD
Προϊστάμενος Γραφείου Φαρμακευτικής Ποιότητας
Ποιότητα και Ασφάλεια Φαρμάκων
Και εδώ έχουμε κάποιες ασάφειες και την αποδοχή των ισχυρισμών του FDA χωρίς καμία αμφισβήτηση ή επίσημη αξιολόγηση των δεδομένων από τις ρυθμιστικές αρχές του EMA:

Προς: Κορακιανίτη Ευδοκία
Θέμα: RE: Ad-hoc λεπτά MLT για σχόλια έως τις 16:30 σήμερα
Αγαπητή Ευδοκία,
Δείτε τα πρόσθετα σημεία που προέκυψαν από την TC με την FDA που μόλις είχαμε: ο FDA μοιράστηκε μαζί μας τις ακόλουθες πληροφορίες: – Ο FDA έχει λάβει 7 εμπορικές παρτίδες DS και 6 επιπλέον παρτίδες DP (2 επιπλέον παρτίδες GMP τις οποίες δεν έχει λάβει ακόμη η ΕΕ). Οι πιο πρόσφατες παρτίδες υποδεικνύουν ότι το %ακέραιο RNA επανέρχεται στο 70 – 75%, γεγονός που μας αφήνει επιφυλακτικά αισιόδοξους ότι πρόσθετα δεδομένα θα μπορούσαν να αντιμετωπίσουν το πρόβλημα.
– Ο FDA και η Health Canada ανέφεραν ότι οι ανησυχίες για την ασφάλεια που σχετίζονται με τα μεταβλητά είδη mRNA/πρωτεΐνης αποτελούν περισσότερο θεωρητικό ενδιαφέρον, καθώς τα άθικτα είδη με κάλυμμα 5′ φαίνεται να παραμένουν συγκρίσιμα (πράγμα που ισοδυναμεί με πλήρως λειτουργικό mRNA)
– Ο FDA/HC/EMA συμφώνησε ότι η ευθυγράμμιση με τις προδιαγραφές % ακεραιότητα mRNA είναι καθοριστικής σημασίας προκειμένου να αποφευχθεί ότι μια περιοχή λαμβάνει όλο το μη βέλτιστο υλικό (ιδίως μια ανησυχία από την Health Canada), οι προδιαγραφές πρέπει να είναι κλινικά πιστοποιημένες
– Ο FDA ανέφερε μια τροποποίηση του πρωτοκόλλου CT για τη σύγκριση της ανοσογονικότητας του υλικού της διαδικασίας 1 και 2. Ωστόσο, δεν είναι σαφές εάν οι ασθενείς έχουν λάβει ακόμη αυτές τις δόσεις. Αυτή η πληροφορία θα ήταν πολύτιμη για να φέρει κλινική γέφυρα στο εύρος των προδιαγραφών για το % της ακεραιότητας του mRNA. πολύ πιθανό να μην είναι διαθέσιμο αν και πριν από το τέλος του έτους
– Ο FDA ανέφερε ότι για ένα πλήρες BLA θα απαιτούσαν 3 παρτίδες PPQ η καθεμία για DP και DS
Ο αιτών μοιράστηκε με τον FDA και το US/MHRA μόνο σήμερα ένα πρόβλημα με ορατά σωματίδια στο DP (φαίνεται ότι είναι συστατικά νανοσωματιδίων λιπιδίων). Η FDA έχει θέσει ερωτήσεις στον αιτούντα, θα κάνουμε επίσης FU για αυτό το θέμα.
Θερμούς χαιρετισμούς,
Βερόνικα
Αυτό που μπορώ να πω κλείνοντας – μέτρησα περίπου 70 διαφορετικά άτομα που αναφέρονται σε όλο το έγγραφο και τα emails που διέρρευσαν, τα οποία διευκόλυναν αυτή την τραγική παρωδία – την “έγκριση” του πιο θανατηφόρου προϊόντος που εξαπολύθηκε ποτέ στον μεγαλύτερο αριθμό ανθρώπων, με αποτέλεσμα έναν άνευ προηγουμένου αριθμό θανάτων και τραυματισμών παγκοσμίως. Ίσως, με λίγες εξαιρέσεις, οι περισσότεροι από αυτούς να εξαπατήθηκαν το 2020 και δεν κατάλαβαν ότι συμμετείχαν σε ένα έγκλημα πολέμου και υπέγραψαν μια θανατηφόρα απάτη. Πιστεύω ότι οι περισσότεροι από αυτούς το γνωρίζουν πλέον, ελπίζω να είναι αρκετά τρομοκρατημένοι με αυτό που επέτρεψαν, και ελπίζω αυτοί οι άνθρωποι να βγουν μπροστά ως πληροφοριοδότες και να αρχίσουν να μιλούν. Χρειαζόμαστε απαντήσεις.
Δημοσιεύθηκε αρχικά από το Due Diligence and Art
Suggest a correction







